

扫码打开虎嗅APP
本文来自微信公众号:奇点网(ID:geekheal_com),作者:谭硕,原文标题:《《自然》:揭开癌细胞“生生不息”之谜!哈佛和MIT团队开发追踪“持久存留”癌细胞的新系统,发现脂肪酸代谢改变或与获得性耐药有关》,题图来自:视觉中国
医学与癌症的每一次较量,都是艰苦卓绝的战斗,胜败都是兵家常事。而即使是医学占了上风,很多时候也只能接受打成“击溃战”的结果,因为要想把癌细胞彻底全歼,实在是非常困难。
尤其是在治疗晚期癌症时,即使有了精准高效的靶向/免疫治疗药物,肿瘤起初缩小也不意味着能赢。一小部分癌细胞可能天生自带耐药特性,或者后天学会了耐药,然后再次复制增殖,变成更棘手的敌人再卷土重来。
这个道理并不难懂,科学家们也很早就定义了这类难缠的癌细胞——“持久存留细胞”(Persistent Cells),但它们到底是怎么躲过治疗手段绞杀的呢?哪些特征可以用来识别和消灭这些残敌?
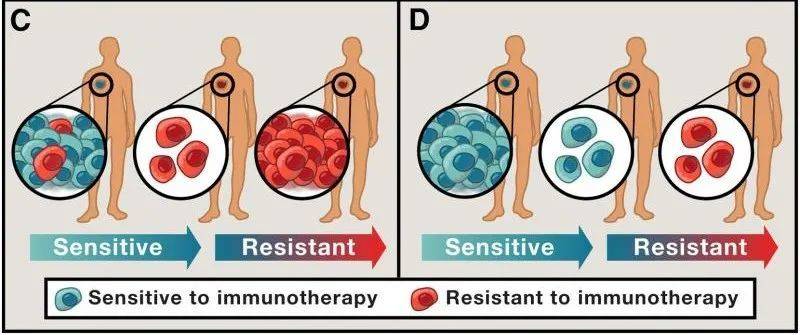
以免疫治疗为例,图C就是典型的“持久存留细胞”导致全面耐药(图片来源:Cell)
近期哈佛大学-麻省理工学院博德研究所团队在《自然》上发表的最新研究成果,就揭示了持久存留癌细胞的一大特征:癌细胞能够在靶向治疗后存活并继续增殖,可能与脂肪酸代谢的改变有关。
研究者们开发了一套名为Watermelon的标记系统,准确捕捉到了少数能增殖的持久存留癌细胞,并发现了这种代谢特征。而在现有靶向治疗的基础上,加用抑制脂肪酸氧化的药物,就有望清除掉这类细胞[1]。
其实把能增殖的持久存留癌细胞揪出来,就已经很不容易了。研究者们以EGFR突变肺癌细胞系作为研究对象,再用第三代靶向药奥希替尼进行治疗,筛选出符合条件的癌细胞,数量还不到初始时的0.5%,占全部耐药细胞比例约为13%。
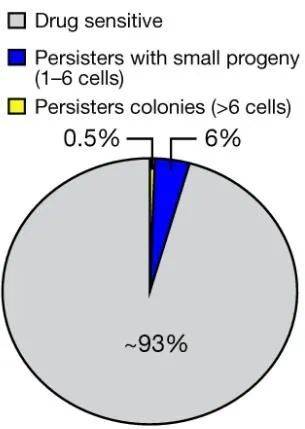
就是这不到0.5%的细胞会是大祸害
Watermelon标记系统就在这时出场了,这套系统使用红绿两色荧光蛋白,对被筛选出的癌细胞进行标记,从而能够在单细胞层面,对每个细胞的转录组学变化和增殖情况进行跟踪,还能上溯到特定细胞的起源。

而重新用奥希替尼处理持久存留癌细胞时,研究者们发现不管是否恢复增殖,癌细胞都重新对奥希替尼治疗敏感,说明这部分癌细胞能存留下来,并不是因为基因层面有什么耐药特性,而是非基因性的耐药机制在作祟。
在奥希替尼再处理14天期间的四个不同时间点(第0、3、7和14天),研究者们对5.6万个标记过的细胞进行单细胞测序,将这些细胞分为循环持久性细胞(Cycling Persistent Cells)、中度循环持久性和非循环持久性细胞。

这三类细胞的祖源并不相同,基因表达特征也有明显差异,其中能够持续增殖、威胁最大的循环持久性细胞,有着更高的谷胱甘肽代谢特征和转录因子NRF2的表达,而且这种特征是奥希替尼处理后才出现的,并不是细胞原有的。
被点名的转录因子NRF2,是细胞内氧化应激诱导表达的结果,而且研究者们发现在奥希替尼处理第14天时,循环持久性细胞表达前十多的基因中,有5个是NRF2的作用靶标,这意味着又牵扯到了细胞抗氧化防御系统。
接下来的实验显示,奥希替尼治疗会影响癌细胞的氧化反应,诱导活性氧(ROS)的增多,而能够熬过来的循环持久性细胞,ROS水平只有非循环持久性细胞的1/3。如果用药物清除掉ROS,循环持久性细胞的比例就会大幅上升。
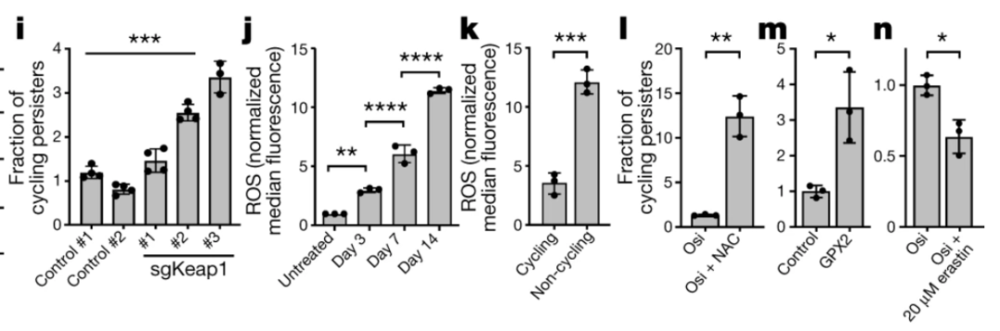
ROS水平的差异是非常明显的
一句话总结,就是循环持久性癌细胞能够耐药+增殖,与细胞的氧化还原状态密不可分,而氧化还原状态又与细胞的代谢有关,所以解谜还得继续下去。
研究者们分析了循环持久性细胞与其它两类细胞的代谢物差异,发现多种代谢物的变化,都能指向脂肪酸氧化(FAO)通路。上调或下调这一通路,都能导致循环持久性细胞的数量明显改变,有脂肪酸代谢细胞就能增殖,没有就不能。
而在用HER2靶向药拉帕替尼处理乳腺癌细胞、BRAF抑制剂达拉非尼处理黑色素瘤和结直肠癌细胞时,研究者们都发现了循环持久性细胞脂肪酸代谢的明显上调,在动物模型和患者肿瘤样本中,也观察到了类似的改变。
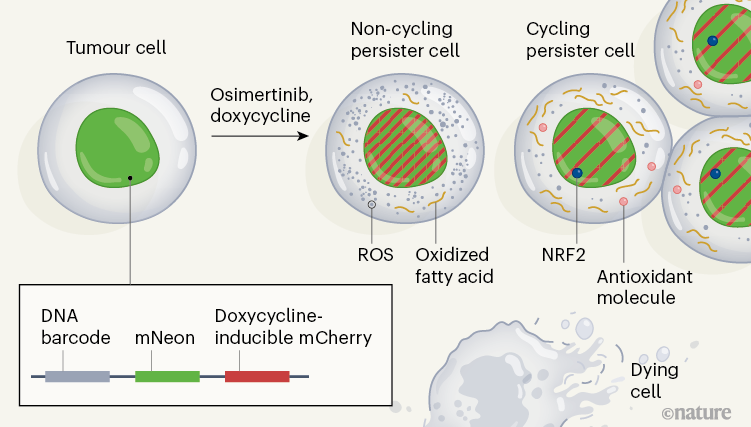
看懂这一张图,就看懂了整个研究
看来循环持久性细胞调整脂肪酸代谢,来躲过药物的绞杀并再次增殖,是一种跨瘤种的普遍现象。而既往提出的耐药治疗策略,如抑制雌激素受体以诱导细胞铁死亡,对这些细胞收效并不好,反倒是抑制FAO通路的在研新药有一定效果。
未来能不能利用这次的发现,把这些可能死灰复燃的癌细胞彻底消灭,就要看科学家们的了。研究第一作者可是在采访时说:“希望有生之年内能告诉一名患者,‘你被彻底治愈了’,因为所有癌细胞都被干掉了。”真是个美好的愿景。
参考资料:
Oren Y, Tsabar M, Cuoco M S, et al. Cycling cancer persister cells arise from lineages with distinct programs[J]. Nature, 2021, 596(7873): 576-582.
本文来自微信公众号:奇点网(ID:geekheal_com),作者:谭硕
