
扫码打开虎嗅APP

对于少数艾滋病毒携带者来说,不接受抗逆转录病毒治疗也能控制病毒。研究发现在这些人体内,整合到宿主基因组中的病毒DNA,处于一种转录受到深度抑制的状态。本文来自微信公众号: Nature自然科研(ID:Nature-Research),原文作者:Nicolas Chomont,题图来自:视觉中国
抗逆转录病毒治疗(ART)彻底改变了我们控制艾滋病毒(HIV)的方式。但ART并不能治愈艾滋病——HIV基因组可以整合进入宿主DNA,以沉默的方式藏匿在细胞中,即使几十年的有效治疗也拿它没办法[1–3]。ART必须终身治疗,才能防止病毒从这些病毒库中反弹。
不过,有一小群(低于0.5%)HIV携带者可以在不接受ART的情况下控制病毒复制,那么,我们能从这群人中找到防止病毒反弹的办法吗?Jiang等人[4]在《自然》上发表了一项研究,将这些被称为“精英控制者”(elite controller)的个体的病毒库与那些接受ART的感染者进行了对比。结果显示,这种精英控制能力与一个很小的病毒库有关,这个病毒库中的HIV不太可能被重新激活。
研究团队首先利用一种复杂的测序技术,对两组人群的数百万个细胞内的病毒基因组(前病毒,provirus)进行了比较。和预期的一样,比较发现精英控制者的HIV基因组拷贝数少于ART治疗组。不过,精英控制者体内发现遗传完整的前病毒比例更高,意味着它们有可能在转录时产生具有传染力的病毒颗粒。
Jiang等人频繁观察到精英控制者体内有许多一模一样的病毒基因组拷贝。这一发现证实[5]了受感染的细胞具有在控制者体内增殖的能力,就像在接受ART的感染者体内一样[6–8]。已知[9]精英控制者能对HIV感染的细胞产生强效的免疫应答,作者还发现,精英控制者体内持续存在的前病毒序列根据预测会产生能被这种免疫应答靶向的病毒蛋白。
那么,这些前病毒是如何逃避免疫应答的呢?为了回答这个问题,作者利用一种最新开发的技术[10],分析了病毒整合进宿主基因组的位点,以及相应的前病毒序列。他们在分析中观察到好几种特征,这些特征显示,在精英控制者中体内发现的前病毒,比接受ART的感染者的前病毒处于更深的潜伏(休眠)状态。
首先,精英控制者的前病毒更有可能整合进基因组的非蛋白编码区域。第二,精英控制者的病毒基因组往往位于着丝粒这一染色体结构的DNA重复序列中,或被其包围。宿主基因组在着丝粒这里被包装进一个DNA-蛋白复合物——染色质,这个包装异常致密,能强烈抑制转录。第三,精英控制者体内有一大部分HIV基因组被整合到编码锌指蛋白家族成员的基因中,已知这里的染色质携带有许多与转录抑制有关的分子修饰[11]。
作者还对染色质开放区域(能进行转录的位置)进行了分析,发现相较于接受 ART的个体,精英控制者DNA中的病毒整合位点离染色质开放区域更远。这一结果支持了这样一种观点,即精英控制者的基因组不太可能主动产生病毒转录体和蛋白。的确,相比接受ART感染者的HIV基因组,精英控制者体内完整前病毒产生的病毒转录体数量是前者的十分之一。
两种情况可以解释精英控制者体内前病毒的这种特征。一种情况是,HIV整合可能更多地发生在这些个体基因组的特定区域。另一种情况是,随着时间的流逝,整合进入非编码或转录抑制区域的前病毒可能会被选择,而更支持病毒转录的则会被淘汰。
对这两种情况做出决定性的区分,需要研究人员长时间随访精英控制者,而这不在这项研究的范围内。不过,Jiang等人在体外感染了来自精英控制者和接受ART的感染者的细胞,结果发现两者的整合模式并无显著差异,这让第一种情况不太成立。
第二种情况的可能性更大,还因为在精英控制者体内经常能观察到对HIV感染细胞具有强效免疫应答的罕见现象。这些应答也许能逐渐清除更易产生病毒蛋白的包含前病毒的细胞(图1)。多年之后,这种选择还能形成一个清一色由不易被重新激活的前病毒组成的病毒库。
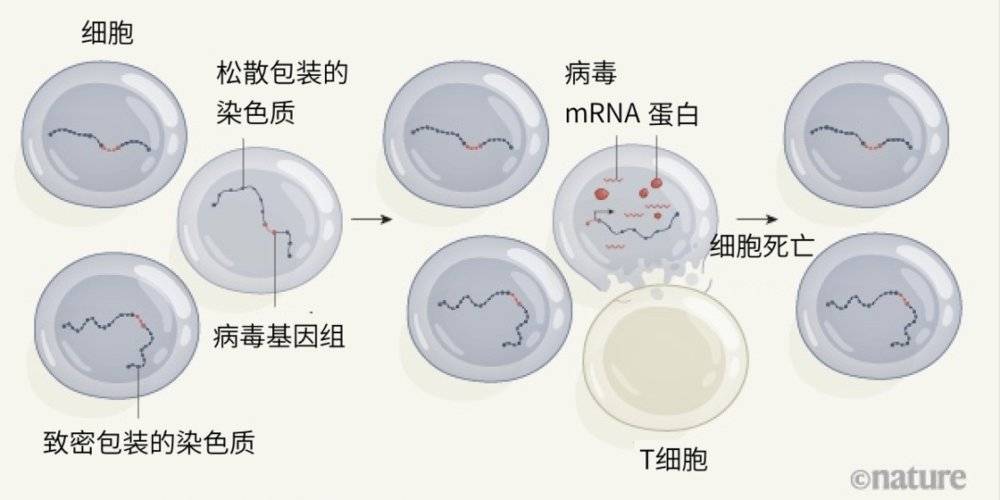
图1:精英控制者对休眠HIV的选择。一小部分HIV携带者可以在不需要抗逆转录病毒治疗(ART)的情况下控制病毒。Jiang等人[4]用证据表明,这些精英控制者体内的病毒DNA会整合进宿主基因组。在一些病毒基因组的整合位点上,宿主DNA与蛋白被松散包装进染色质,这意味着可以发生转录。在其他病毒DNA整合的宿主位点上,转录会受到抑制,因为那里的染色质包装更致密。免疫T细胞能高效靶向转录病毒(产生病毒信使RNA和蛋白)的细胞——这种应答只出现在精英控制者体内。随着这些细胞被杀死,一个由深度潜伏的HIV基因组组成的小细胞库逐渐在演化过程中被选择。
这种论点得到了既往研究[12]的支持——之前的研究显示,精英控制者体内有复制能力的病毒数量极少。此外,在Jiang等人的研究中,虽然作者对其中一位受试者的10亿多个细胞进行了彻底分析,但完全检测不到有复制能力的HIV。这名个体体内的HIV是否已经完全清除很难证明,但这个案例确实让人想起治愈HIV的先例[13,14]。
虽然精英控制者在HIV携带者中只占一小部分,但Jiang等人的研究对其他的HIV携带者具有多重意义。研究表明,深度休眠的前病毒可能在利用ART抑制病毒多年之后依然挥之不去,特别是能对HIV维持免疫应答的人群。经年累月持续的免疫压力或许会选择出一个小病毒库,该病毒库中的HIV不太会“死灰复燃”。不过,深度休眠的病毒基因组是否能被重新激活,以及能否促进病毒在ART治疗期间的反弹,依然有待确定。
无论哪种情况,研究结果告诉我们,在对能导致病毒反弹的持续性HIV病毒库的规模进行评估时,应该同时测量病毒基因组的完整性和激活潜力。目前用来评估病毒库规模的方法要么只测量完整HIV基因组的数量,要么只测量它们在体外产生RNA或蛋白的能力。
Jiang等人的研究表明,有必要结合这两种测量手段,因为许多完整的基因组可能无法被轻易重新激活。而结合两种测量手段或能帮助研究人员和临床医师更好地预测ART治疗后的病毒反弹情况。
研究表明,长期持续的细胞免疫压力或能选择出一个由难以重新激活的HIV基因组组成的细胞库,从而让HIV病毒库的规模随时间流逝而显著缩小。
这反过来说明,免疫细胞疗法——包括目前正在开发用来控制HIV病毒库的基于CAR T细胞的疗法[15]——不仅有可能在ART治疗期间控制病毒反弹,还可能将病毒库缩小到只剩一些深度休眠的前病毒。当然,这是否能长期缓解HIV感染,依然是一个未知问题。
参考文献:
1. Finzi, D. et al. Science 278, 1295–1300 (1997).
2. Wong, J. K. et al. Science 278, 1291–1295 (1997).
3. Chun, T. W. et al. Proc. Natl Acad. Sci. USA 94, 13193–13197 (1997).
4. Jiang, C. et al. Nature 585, 261–267 (2020).
5. Boritz, E. A. et al. Cell 166, 1004–1015 (2016).
6. Wagner, T. A. et al. Science 345, 570–573 (2014).
7. Maldarelli, F. et al. Science 345, 179–183 (2014).
8. Simonetti, F. R. et al. Proc. Natl Acad. Sci. USA 113, 1883–1888 (2016).
9. Migueles, S. A. et al. Immunity 29, 1009–1021 (2008).
10. Einkauf, K. B. J. Clin. Invest. 129, 988–998 (2019).
11. Vogel, M. J. et al. Genome Res. 16, 1493–1504 (2006).
12. Blankson, J. N. et al. J. Virol. 81, 2508–2518 (2007).
13. Hutter, G. et al. N. Engl. J. Med. 360, 692–698 (2009).
14. Gupta, R. K. et al. Nature 568, 244–248 (2019).
15. Herzig, E. et al. Cell 179, 880–894.e10 (2019).
原文以HIV enters deep sleep in people who naturally control the virus为标题发表在2020年8月26日的《自然》新闻与观点版块
本文来自微信公众号: Nature自然科研(ID:Nature-Research),原文作者:Nicolas Chomont