

扫码打开虎嗅APP
本文来自微信公众号:返朴 (ID:fanpu2019),作者:玉宝,原文标题:《好快的染色体变异!岛上小鼠千年分化为六种》,题图来自:视觉中国(美丽的马德拉岛海滩)
迅速变异:千年形成六个新物种
在葡萄牙的马德拉岛*,生活着六种长相相似的小鼠,可称之为马德拉鼠。它们虽然看起来非常相像,但却存在生殖隔离,也就是无法在自然条件下相互交配,或交配后无法产生可育的后代,这符合生物学上划分新物种的标准,因此这六种小鼠属于不同的物种。

马德拉鼠。图源:Sofia Gabriel
科学家研究发现,这六种小鼠是在过去的一千年当中分化而成;在一千年前,它们有着共同的祖先。2000年的一篇Nature论文[1]提升了学界对马德拉鼠的研究热度,马德拉岛随后就像太平洋上的加拉帕戈斯群岛一样,成为研究生物演化的另一个圣地。众所周知,1835年参加远洋航行的达尔文就是在见到加拉帕戈斯岛上的象龟、达尔文雀等特有物种后,逐步形成了生物演化理论或进化论。
*马德拉群岛属于葡萄牙领土,人口约25万,位于葡萄牙本土西南方向1077千米。岛屿最长处57千米、最宽处22千米。这里也是著名球星C罗的故乡。
生活在马德拉岛上的小鼠有什么特别之处呢?科学家发现,它们的基因数目差别不大,但染色体的结构和数目会有所差异。这说明,马德拉小鼠的演化走的不是基因变异的路线,而是通过我们较少听说的染色体变异(chromosomal variation)来完成的。
普通实验室小鼠(Mus musculus)的染色体数目是20对40条,而马德拉鼠的染色体数目介于22~40条之间。大部分突变的马德拉鼠很难产生下一代,要么在胚胎期死亡,要么在出生后因各种缺陷而死亡。少数能够繁育且能适应当地环境的,就会把变异保留下来,也就是我们现在看到的六种马德拉鼠。
罗氏易位:也曾造就人类
借助染色体显带技术,科学家在实验室可以轻易发现染色体的各种数目和结构变异。造成马德拉鼠染色体差异的主要原因是发生了罗宾逊易位(Robertsonian translocation),简称罗氏易位。
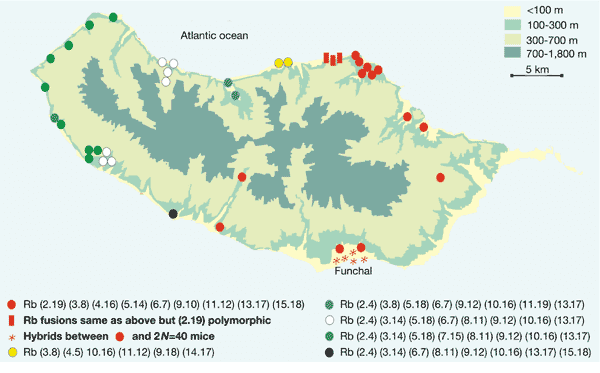
马德拉鼠的罗氏易位分布。罗氏易位在种群中非常常见,不过大部分易位不会传给下一代。[1]
罗氏易位是指某两条染色体的长臂融合成为一条染色体,并失去短臂。在细胞分裂的中期,有些染色体的着丝粒会位于染色体的一端,其短臂极短,这一类染色体称为近端着丝粒染色体,罗氏易位往往发生在近端着丝粒类型的染色体之间。例如,人类的二号染色体,就是在数百万年之前由两条染色体发生了罗氏易位融合而成的[2]。据统计,罗氏易位在新生儿中的发生率是千分之一[3],大部分患儿会产生健康问题,如唐氏综合征和巴陶氏综合征。
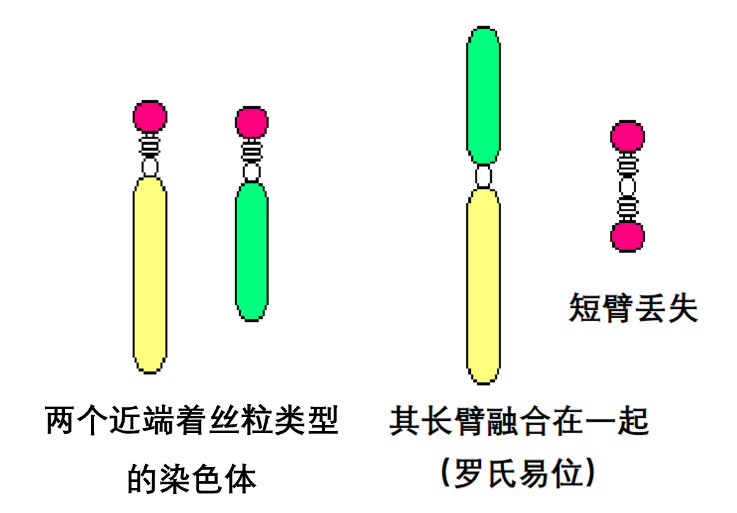
罗氏易位原理图(作者作图)
马德拉鼠的罗氏易位情况与人类似:在鼠群中以一定概率发生,少部分不影响生殖和健康的易位被保留下来,进而逐步在种群中扩散,甚至形成新的小鼠类群。在这个740平方千米的岛屿上,目前确定有六种小鼠,它们的染色体核型明显不一样。可以想见,随着采样密度增加或时间推移,大概率还会发现/出现新的小鼠种系。
据推测,岛上的小鼠祖先来自一千年前在此停靠的维京海盗船,另一个说法是随15世纪葡萄牙殖民者的船而来。在现当代,随着船舶或压舱水而蔓延到世界各地的动物造成的物种入侵案例,也是数不胜数。
回顾中学生物知识,1个卵母细胞经过两轮减数分裂,形成了1个卵细胞和3个极体。极体的命运是退化消失,只有卵细胞才会参与受精过程和个体发育。中学教科书写着,物种染色体突变的特点是无偏好、随机发生,后代比例符合孟德尔遗传定律。但马德拉鼠的染色体分离并不如此:在雌性小鼠减数分裂过程中,罗氏易位大概率会借助卵细胞传给下一代,而不是进入极体走向“绝路”。因为极体的命运是退化或死亡,并不参与受精过程及个体发育。
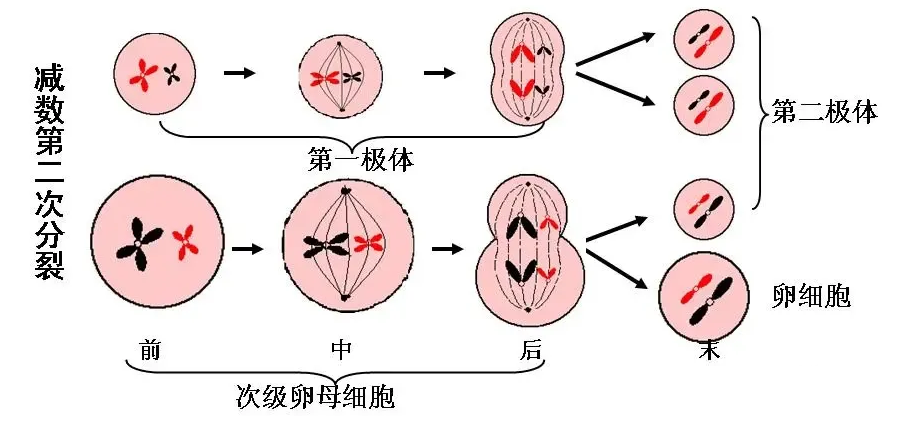
减数第二次分裂,形成1个卵细胞和3个极体;极体退化死亡。
那么,为什么发生了罗氏易位的“大染色体”(两个长臂融合,染色体体型较大)倾向于进入卵细胞而不是极体?
答案在着丝粒上。着丝粒是真核生物细胞中连接纺锤丝和染色体的结构。研究发现,罗氏易位后形成的染色体往往DNA含量更高,附着了更多的着丝粒蛋白,因此“大染色体”更容易分配到卵细胞中而不是极体中。

染色体示意图。①染色体分节 ②中节,将染色体分为二臂。中节包含着丝粒(kinetochore),着丝粒是一种复合蛋白,将染色体和纺锤丝微管相结合。③短臂 ④长臂丨来源:Wikipedia
自私染色体,善于“搭便车”
动物学家Michael J. D. White在50多年前曾提出,罗氏易位善于搭减数分裂的“便车”而传下去。他认为,“少数染色体重排——例如罗氏易位——能够在物种形成中发挥作用,在雌性的减数分裂过程中产生特定的优势,进而通过这些机制形成生殖隔离”。马德拉鼠染色体变异的机制证明了他的理论。
植物中是否也有类似的现象?
实际上,在马德拉鼠之前,科学家就发现玉米和黄色猴面花等植物中具有大染色体的表型。

Ab10突变体玉米
1942年,遗传学家Marcus Rhoades发现[4],玉米的10号染色体有一个普遍发生的变异——Ab10,也是由罗氏易位形成的。具有Ab10突变染色体的玉米棒以黑粒玉米为主,间杂少量黄粒,而黑粒玉米棒出现的概率远远高出随机发生的比例。对此,Rhoades提出的解释是:
带Ab10的染色体更容易进入到发育成卵细胞(而非极体)的位置,因此易位的后代个体数更多,其后代比例不符合孟德尔定律。现在我们知道, Ab10的确在减数分裂过程中更容易进入卵细胞,这和马德拉鼠的罗氏易位是相似的。
Rhoades的发现是历史上对“减数分裂驱动”现象的第一例报告。所谓减数分裂驱动,是指机体的染色体在减数分裂时因自私基因干扰, 后代比例偏离了孟德尔遗传的期望比例。受“自私基因”(selfish gene)概念启发,人们把玉米的10号染色体称为“自私染色体”。直到2018年,才有一篇论文解释清楚了Ab10的发生机制,揭示了参与这一过程的核心蛋白KINDR以及它的功能[5]。
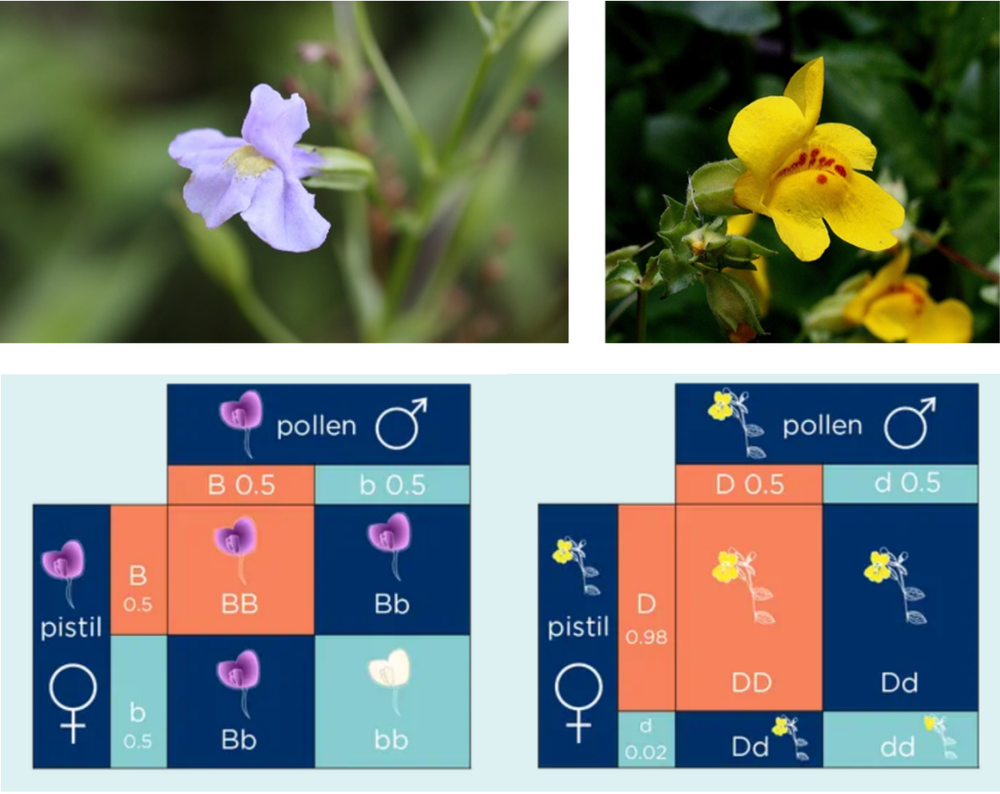
常见的猴面花品种之一(左上)和黄猴面花(右上)。黄猴面花野生型(左下)卵子显性比例是50%,后代比例符合孟德尔遗传定律。而发生罗氏易位的突变型黄猴面花(右下图),98%的卵子都是突变携带者,后代比例不再符合孟德尔遗传定律。
黄猴面花(Mimulus guttatus)的遗传是减数分裂驱动(Meiotic drive)理论的另一个例证。2008年一篇论文表明[6],大着丝粒的黄色猴面花个体会产生更多后代,甚至显性纯合后代比例占实验群体总数的50%左右,而按孟德尔遗传定律这一比例应该是25%才对。参与这一机制的分子有CENP-A和CenH3等。
频繁的变异:为自然选择提供素材
通过上述案例,大家知道着丝粒在减数分裂中扮演的角色十分重要,没有它,减数分裂、有丝分裂都无法进行。那么,从常理出发,着丝粒的基因序列和蛋白在演化上应该非常保守(不轻易发生改变)才对,但事实是,真核生物的着丝粒蛋白以及基因都不保守,变异非常快。
为什么会发生这种悖论?2001年有科学家解释说[7],是因为着丝粒参与了减数分裂驱动。根据这一解释,着丝粒的基因序列——如玉米的Ab10——想“绑架”行使染色体分离功能的“机器”,使这个“机器”不断产生染色体变异,例如产生染色体非整数倍的卵细胞。变异的“危害”有大有小、也有中性突变,并非都是致死性的,所以这一过程就一直在快速演化,而没有从群体中消失。
在小鼠中,减数分裂驱动现象同样存在。科学家发现,具有GTP酶活性的Ran和Cdc42的表达产物(蛋白质)参与了减数分裂驱动,影响到纺锤体的定位和极性建立[8]。通过把“大着丝粒”表型与“小着丝粒”表型的小鼠杂交,科学家发现,含“大着丝粒”鼠的染色体更容易进入卵细胞而不是极体。
演化从未终止,筛选无处不在。对于机体演化适应性,减数分裂驱动或“自私染色体”有什么意义呢?
至少有一点是明确的:通过调控着丝粒与纺锤体微管相互作用,同源染色体会出现功能上的差异,为自然选择提供源源不断的素材。唯有如此,当自然环境或人工环境变动不居时,总有一部分携带某些变异的生物可以适应,逐渐造就更多的品系乃至物种。
要知道,数百万年前的一次罗氏易位使得人的祖先与猿的祖先分离,类人猿才逐步演化成当今的人类。
参考文献
[1] Janice BD et al, Rapid chromosomal evolution in island mice. Nature 2000, 403(6766): 158
[2] Paweł Stankiewicz. One pedigree we all may have come from –did Adam and Eve have the chromosome2 fusion? Molecular Cytogenetics 2016, 9:72
[3] Song JP et al. A family with Robertsonian translocation: a potential mechanism of speciation in humans. Mol Cytogenet. 2016, 9: 48.
[4] Rhoades M. Preferential segregation in maize. Genetics 1942, 27:395–407.
[5] R. Kelly Dawe et al. A Kinesin-14 Motor Activates Neocentromeres to Promote Meiotic Drive in Maize. Cell 2018 173(4), P839-850
[6] Finseth Fret al. Selfish chromosomal drive shapes recent centromeric histone evolution in monkeyflowers. PLoS Genet 2021, 17(4): e1009418.
[7] Harmit S Malik et al. Conflict begets complexity: the evolution of centromeres. Cur Opin in Gene & Dev 2002, 12: 711–718
[8] Benoit D et al. Ran GTPase promotes oocyte polarization by regulating ERM Ezrin/ Radixin/ Moesin inactivation. Cell Cycle. 2013 Jun 1;12(11):1672-8.
本文来自微信公众号:返朴 (ID:fanpu2019),出品:中国科协科普部,作者:玉宝
