
扫码打开虎嗅APP

本文来自:奇点网,作者:应雨妍,虎嗅获授权发表。
开发新药一直是各个制药公司的重点业务,但是开发新药所需的时间周期很长,对人力、物力都有很高的要求。那么如果能够使用已有的药物去治疗另一种疾病,对于疾病的攻克和研发压力的缓解都是极好的。
关注这个领域的学者着实不少,来自上海交通大学的丁显廷教授就是其中之一。上个月,他在《自然》杂志上发表文章,呼吁在药物筛选领域,应该更加重视老药新用的研究,改变药物原本的用途。丁教授的观点是:疾病是多种病理现象的综合,选择协同作用的药物进行联合治疗应该是事半功倍的。
另外从商业角度上来说,大多制药公司对测试专利已经到期的老药没什么兴趣,但是提倡“老药新用”很有可能能够给它们带来新的价值和商机。因此丁教授也建议,政府可以适当介入,进行资助,方便这些研究的开展。[1]

丁显廷教授
之所以提出这样的观点,当然与现代科学研究中不少“老药新用”的发现脱不了干系。我们首先要说的就是癌症治疗领域,在各种治疗方法“八仙过海,各显神通”的时候,一种不起眼的治疗疟疾的药物正击中了牛津大学几位科学家的“研究靶心”!他们发现常用的抗疟疾药物Atovaquone可以提高癌症治疗中放疗的效率,研究结果发表在了《自然通讯》杂志上。
抗疟疾药物与癌症放疗的“携手”
放疗是临床上治疗癌症的常见方法,利用射线照射肿瘤区域,破坏癌细胞的DNA物质和细胞膜结构,从而抑制癌细胞的分裂和生长速度,使肿瘤缩小甚至根除。根据统计数字,我国每年有65-75%的癌症患者需要放疗。
但是,很残酷的一个事实是,放疗的“大好疗效”多半只对初期癌症或是中期癌症患者有效。对于晚期患者来说,医生只能使用姑息性放疗来为患者止痛、缓解压迫等等,减轻患者在弥留之际的痛苦。
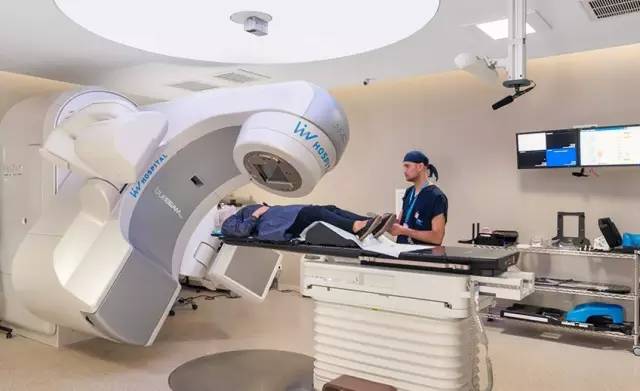
这是为什么呢?
因为在大型肿瘤里癌细胞的生长速度超过了血液能够提供氧气的能力,使得有相当一部分癌细胞处于缺氧状态。在这种缺氧状态下,癌细胞内没有足够的氧自由基与被射线破坏的DNA结合,使得被破坏的DNA非常容易被修复,于是放疗就被“拖了后腿”。
所以不难猜测,Atovaquone的作用就是可以有效增加癌细胞内的含氧量,让被破坏的DNA失去被修复的机会,让放疗在晚期癌症患者体内也可以发挥自己的优势。Atovaquone作为抗疟疾药物来说,对人体细胞内线粒体有着较弱的抑制作用,因为线粒体是氧气进入人体后最终的消耗场所,所以这一抑制作用代表着细胞对氧气的利用速度会减慢,那么细胞内的含氧量自然也就会提高了。
实际试验中,体外培养的咽癌和肺癌肿瘤模型中,配合Atovaquone的放疗杀死了90%的癌细胞。在治疗有咽癌的小鼠时,Atovaquone组肿瘤的生长速度比单接受放疗的小鼠慢了约一倍。此外,在对癌细胞存活率的统计中,Atovaquone组也遥遥领先,癌细胞存活率下降的比例最高可达56.2%!
随着实验的成功,领导这项研究的Gillies McKenna教授也已经开始在肺癌患者中进行初步小规模的临床试验,如果同样能够出现实验室结果的话,那么大范围的临床试验也只是时间问题。[2]
癌症治疗药物对心血管疾病的“克制”
现有疟疾药物“克”癌症,但是癌症药物也“不甘寂寞”。科学家们之前有一个很有意思的发现,人体内的健康细胞都会携带一种蛋白——CD47,CD47会附着在细胞表面,告诉免疫系统中的巨噬细胞“不要吃我”。而癌细胞则“画风清奇”,一边表明“不要吃我”,一边则释放“来呀!来吃我!”的信息,虽然这样,但是巨噬细胞只要识别到“不要吃我”的信息就不会去吞噬它。
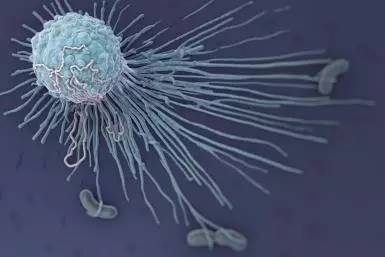
巨噬细胞
利用这个漏洞,科学家们用抗CD47抗体,把“不要吃我”的信号“屏蔽”,这样,“一心求吃”的癌细胞就被巨噬细胞吞掉了。普通的细胞在即将死亡的时候CD47蛋白也会慢慢消失,当巨噬细胞接收不到CD47蛋白的信息后,就知道这些细胞已经“死掉了”,就会“开工”吞掉这些细胞。
巧的是,一批来自斯坦福的科学家在动脉粥样硬化斑块中发现了许多即将死亡和已经死亡的细胞,它们本应被巨噬细胞吞掉,却不知道为什么“苟活”了下来。动脉粥样硬化是冠心病、脑梗的主要原因,于是研究人员想,利用CD47抗体是不是能够阻止这些疾病呢?
于是他们在小鼠体内模拟出了动脉粥样硬化环境,利用抗CD47抗体去治疗,果然发现,它能阻止粥样斑块堆积,甚至一大部分小鼠还出现了粥样斑块缩小的现象!要知道,这在心血管模式小鼠中是很难见到的。[3]
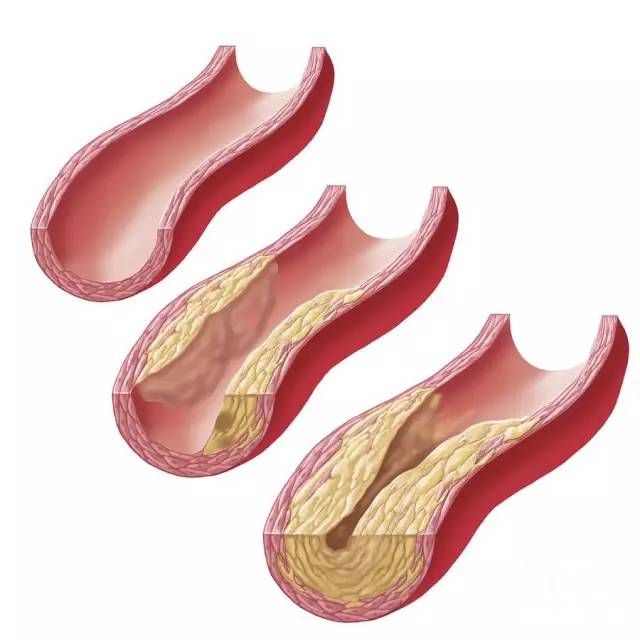
动脉粥样硬化示意图
是什么使得粥样硬化斑块周围的“苟活细胞”表面的CD47蛋白没有消失呢?这要“归罪于”一种因子TNF-α。实验证明,TNF-α能够促进CD47蛋白的过表达,阻止即将死亡的细胞中CD47蛋白水平的下降,而反过来,堆积在粥样斑块周围的“苟活细胞”又能够释放促进产生TNF-α的物质。这样的一个恶性循环使得巨噬细胞“在工作中被蒙蔽了双眼”,不过好在抗CD47抗体能够阻止这一恶性循环的发生。对于这一成果,研究人员们已经申请了专利,临床试验的开展也蓄势待发。
止痛药实现阿尔茨海默氏病病情的“逆转”
说了癌症和心血管疾病之后,我们也来说说慢性病。对于广大女性同胞来说,痛经应该是个熟悉的体验,应该也有很多姑娘吃过止痛药,有一种止痛药的成分是甲灭酸,俗名叫扑湿痛。甲灭酸属于非甾体类消炎药物,能够消炎、镇痛,但是甲灭酸的副作用在同类药物里是比较严重的,所以一般只作为短期镇痛药物使用,它对痛经的疗效尤其好。
可能是这一作用太过突出,让大家几乎忘记了它还能够消炎,而甲灭酸的“老药新用”就和消炎功效有关系。
曼彻斯特大学的研究人员发现,甲灭酸可以逆转阿尔茨海默氏病小鼠记忆力丧失这一情况!研究的负责人David Brough博士介绍,目前已经有证据显示,大脑中的炎症使得阿尔茨海默氏病患者的病情恶化,而这个研究则是通过抑制了脑中形成炎症的一个通路(NLRP3 inflammasome)来减少脑细胞的损伤。而且目前为止,这是第一例有可能逆转阿尔茨海默氏病的药物![4]

David Brough博士
文章一经发表在《自然通讯》杂志上,就引起了广泛的讨论,因为这项研究只在小鼠体内获得了成功。实验组有10只患有阿症记忆力衰退的小鼠,研究人员用皮下植入的方法给它们注射甲灭酸。同时,还有一组10只小鼠,也用同样的方法注射安慰剂,经过一个月的时间,实验组小鼠的病情完全被逆转!它们恢复到了未得病的状态。
对于这一结果,阿尔茨海默氏病协会的Doug Brown博士表示,这是一个很有前途的研究结果。如果在临床试验中获得成功,那么这与从零开始研发一款新的治疗阿症的药物相比,要提前15年的时间。正因如此,大家都非常期待这一药物的后续试验的开展。
尽管我们得承认,这些药物的“新用”还都没有真正地在临床人体试验中获得成功,但是总要迈出这一步,才能看到希望。无论这三个研究最后的临床结果如何,我想它们对于制药领域的启发都是非常可贵的。
参考文献:
[1] Ding X. Drug screening: Drug repositioning needs a rethink[J]. Nature, 2016, 535(7612): 355-355.
[2] Ashton T M, Fokas E, Kunz-Schughart L A, et al. The anti-malarial atovaquone increases radiosensitivity by alleviating tumour hypoxia[J]. Nature Communications, 2016, 7.
[3] Kojima Y, Volkmer J P, McKenna K, et al. CD47-blocking antibodies restore phagocytosis and prevent atherosclerosis[J]. Nature, 2016.
[4] Daniels M J D, Rivers-Auty J, Schilling T, et al. Fenamate NSAIDs inhibit the NLRP3 inflammasome and protect against Alzheimer/'s disease in rodent models[J]. Nature Communications, 2016, 7.
未经授权不得转载,如需转载请联系微信公众号:奇点网(geekheal_com)获取授权。