
扫码打开虎嗅APP

本文来自微信公众号:Nature Portfolio (ID:nature-portfolio),作者:Alison Abbott,题图来自:《小偷家族》
在去年十二月召开的国际阿尔兹海默大会上,神经科医生Reisa Sperling上台受领终身成就奖。过往的成就固然值得庆贺,不过让她更激动的在于未来。
Sperling因其在治疗阿尔兹海默症临床试验方面的工作而获奖。让她激动不已的,是阿尔兹海默症有了希望——该领域内久违的希望。大多与会人员也深有同感。
就在大会前几个月,研究人员宣布一种抗体药物,lecanemab单抗,能明显降低临床试验受试者大脑淀粉样蛋白斑块的数量——这种蛋白是疾病的明显征兆——还能延缓患者认知能力下降速度。
Sperling在哈佛医学院运行着一个实验室。在会上,她振奋地握紧了麦克风。在研究阿尔兹海默症挫折不断的三十多年后,她说,终于有了证据表明她和同事走的道路是正确的。“但这还远远不够。”她说。

脑扫描图能显示阿尔兹海默症导致的脑受损程度
在这项临床试验中,治疗能让衰退延缓25%,足够为患者多争取几个月的自主生活[1]。“但真正攻克一种影响全球几千万人的退行性疾病,还是另一回事。”她说。
而且lecanemab还有个缺点(在美商品名为Leqembi):它给药方式苛刻。这种药物必须由专业护理人员进行静脉输注。并且因为该药会引起可能危及生命的脑水肿和出血,所以使用这种药的患者必须进行定期监测。
一种类似的单抗aducanumab在2021年获得了美国食品药品监管局批准,但这个决定颇受争议,因为该药的临床试验并未显示确切的获益。
尽管瑕疵尚存,lecanemab的试验结果让人们有了更踏实的希望:只要治疗足够早,阿尔兹海默症最终是能预防的。试验取得成功也带来了另一种可能性:联合使用这一药物和未来的药物,能治疗由不同分子主导的不同疾病阶段。没多少人认为一种药物就能包办一切。但联合疗法的试验昂贵且复杂,因为每种药物都必须进行单独和联合测试。药企对于把自己的产品跟其他药物联合可能会有所顾忌,因为联用失败会影响到自己的药物。
在这个领域里人们信心满满,不仅是因为抗淀粉样蛋白抗体取得了成功。柜子里满是可能的新疗法,还有等待拂去灰尘、变废为宝的弃药。
联用有希望
阿尔兹海默病初期病程长、起病隐匿。斑块——粘性淀粉样β蛋白团块——会最先开始在大脑堆积,然后迅速被称为小胶质细胞的免疫细胞所包围。后者会尽力清除斑块但最终失败。斑块继续增大、变多,但几年甚至十几年都不会被察觉到,直至引起另一种蛋白(Tau蛋白)的积累直至毒性水平,并以缠结形式在大脑中扩散。科学家们还在探究这一连串的事件究竟是如何发生的,但要等这一过程进展已深,认知症状才开始显现。症状的严重程度也跟Tau缠结的程度有关。
Tau靶点的单一药物尚未在试验中取得效果[2],但科学家认为降解Tau的药物和抗淀粉样蛋白药物联合使用,效果可能更好。
“我们已知淀粉样蛋白以某种方式驱动了病理性Tau蛋白堆积,随后Tau蛋白像野火一样在大脑中扩散。”华盛顿大学神经科医生Randall Bateman说,“所以我们认为把燃料清除是有意义的,同时也试着扑灭Tau缠结的火焰。”

Randall Bateman(左)和同事将开展抗Tau和抗淀粉样蛋白的联合试验。图源:Matt Miller/华盛顿大学医学院
Bateman和同事在2015年开始计划联用试验,但直到最近首个证据表明淀粉样蛋白治疗有效,这个试验才变得可行。去年他们启动了一项国际性临床试验Tau NexGen。他们会招募168名受试者,全部都是有可能患阿尔兹海默症的中青年——基本都在30到50多岁,因为这些人携带一个基因突变,会产生过量的β淀粉样蛋白。
受试者被分成两组:已经产生失智症状组,或预计未来十年内出现症状组(这些人继承了父母的突变,他们产生症状的年龄通常和他们父母相同)。
所有受试者都会接受lecanemab和降Tau抗体的治疗,但顺序会不一样。无症状患者会先接受1年的抗Tau抗体E2814治疗,然后加用lecanemab;有症状组会先接受6个月的lecanemab治疗,然后加用E2814治疗。开展这个试验的研究人员希望能通过这样的设计,了解最优联用方法。
之后会有更多的抗Tau药纳入该研究,预计首个试验结果在2027以后取得。
Tau NexGen是首个也是目前唯一一个进行中的联合药物治疗阿尔兹海默症的临床试验。美国有一项类似的试验[3]正在计划中,预计治疗散发、晚发的阿尔兹海默症,这种类型影响的是老年人,绝大部分患者都是此类。美国国立卫生研究院(NIH)会在接下来几个月里决定是否与药企合作共同资助这项称为ATP试验的工作。如果成功资助,明年就能开始招募受试者。
很多制药公司、生物科技公司都在研发抗Tau疗法,有些是抗体,有些是用小分子或是更新的基因疗法,来阻断病理性Tau的合成过程。ATP试验的共同负责人、加州大学旧金山分校的神经学家Adam Boxer透露,有几家公司已经正式表达了参与试验的兴趣。
ATP试验跟Tau NexGen一样,会是个预防性试验。受试者症状会很少或检测不到症状,但会有血检验和头扫描的证据显示脑内已有斑块及Tau缠结的早期表现。试验会纳入900名受试者,分入6个试验臂,分别接受两种Tau药物之一的单药,联合lecanemab、lecanemab单药,或安慰剂。
研究团队希望抗Tau治疗会提高lecanemab的较小获益——在良性循环中,降低斑块负荷后,lecanemab会为抗Tau药起效创造更好的条件。
这些试验的关键是一组敏感的新型生物标志物——能读出疾病状态的脑或血检测值。脑扫描能监测淀粉样斑块和Tau缠结的有无和严重程度;血液或脑脊液检验能测量病理过程中多种分子,比如不同形态的淀粉样蛋白和Tau蛋白。研究人员希望由此得到的大量分子和临床数据,会帮助我们进一步揭示阿尔兹海默症的发病机制。Boxer说:“目前的证据指出Tau蛋白启动了阿尔兹海默症症状显现、致残,直至死亡。但这个假说需要在人类中得到证实。”
联合药物试验有一些缺点:它们通常复杂且管理成本很高。Boxer预计,即便有新生物标志物使试验变得高效,开展ATP试验也要花费好几亿美元。
抗体本身制成药物就很贵。Lecanemab上市价格会定在每年26500美元。Aducanumab(美国商品名为Aduhelm)最初定价在每年56000美元,但是制造商在公众抗议下把价格减半了。
患者用药也不方便,因为他们必须每隔几周就接受一次输注。南加州大学神经科医生、美国阿尔兹海默症临床试验联合会的负责人Paul Aisen说,临床试验数据提示终身治疗才能控制阿尔兹海默症。他提到“停止输注后疾病似乎会反弹”。由于长期单抗治疗不现实,他说在抗体清除斑块后,“我们认为用阻断多肽合成的口服药维持低淀粉样蛋白状态可能有意义。”
这样的药确实有。从2010年左右开始,研究人员就试验了一系列口服药,旨在通过调低β和γ分泌酶这两种合成关键酶的活性,从而降低大脑淀粉样蛋白量。但是这些药物的临床试验全军覆没[4],对它们的关注也消减了——直到迎来了现在的第二次机会。
其他突破
2018年,部分药企达成共识,要在这个通常相当保密的行业中做些不同寻常的事情。他们决定在彼此和阿尔兹海默症协会召集的专家团队间共享六个失败试验的保密临床数据。该协会位于芝加哥,是一家呼吁患者人权的游说团体。
协会希望尽可能多地从失败的临床试验中获取经验。每个试验都测试了一种不同的β分泌酶抑制剂。所有这些药物都没有取得临床获益——甚至更差,好几种产生了毒副作用,包括在某些情况下会加重认知障碍。协会想仔细研究这些试验数据,而非将其束之高阁。协会首席科学家Maria Carrillo说,他们的目标是“帮助业内进一步理解这些试验性药物所针对的疾病相关生物学问题”。
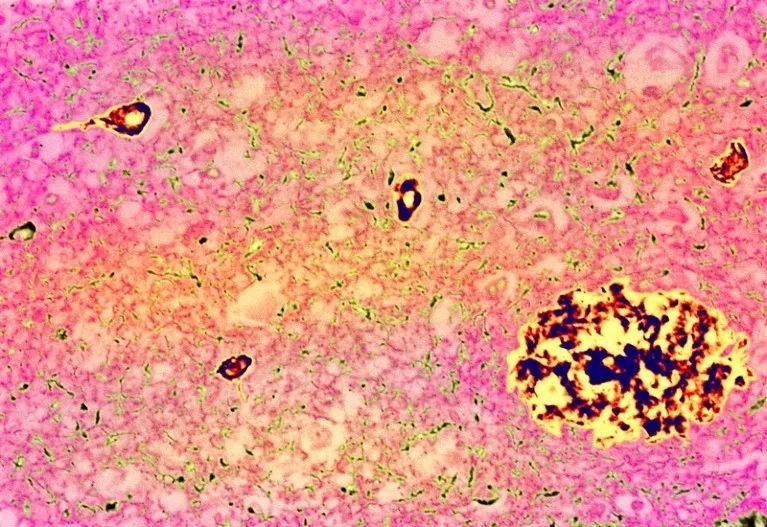
阿尔兹海默症的典型特征:斑块(大团块)和Tau缠结(小团块)。图源:Simon Fraser/ Science Photo Library
协会2021年发表的综述文章表明,这些临床试验的受试者可能已经处在非常晚期的疾病阶段,无法让这类药物起到改善症状的作用;文章还提示降低剂量可能会避免副作用发生[5]。
Aisen认为,一旦现有斑块已用抗体清除后,小剂量用药应有可能防止斑块复发。
以γ分泌酶为靶点的一批临床试验也失败了。但是研究人员没有放弃这个靶点,他们正在研究更加细致的药物作用。他们没有完全阻断这个酶——它不好用,试验中观察到会导致毒副作用——而是希望能改变酶的行为。
一个学术合作开发出了一种这样的调节剂[6],今年会在早期临床试验里测试。这种药物可以口服,能让γ分泌酶把淀粉样蛋白分解成无毒性甚至具有保护性的短链蛋白。该试验会由Acta Pharmaceuticals这家新的初创公司和NIH共同资助。
多数纳入联合疗法试验的药物靶点都是淀粉样蛋白或Tau。但也有更早期的治疗方法,试图提高大脑自然的免疫防御机制对抗阿尔兹海默症。又一次,携带阿尔兹海默症易感基因突变的家族让研究人员学到了很多。
问题突变基因名为TREM2,它编码大脑免疫系统的战士,小胶质细胞,表面的一个分子。“调高小胶质细胞的功能,会让这些细胞更高效地清除斑块、防止淀粉样蛋白病理的扩散,”慕尼黑大学神经科学家Christian Haass说,“特别是如果抗淀粉样蛋白药物能先降低斑块负荷的话。”他计划开展小鼠实验,研究能结合TREM2并激活小胶质细胞的抗体联用抗淀粉样蛋白药物的作用。一种类似的抗体已经进入早期单药临床实验。
疫苗、基因、血液
许多对抗阿尔兹海默症的疗法都在进入临床试验的进程中。研究人员的目的是把有效的分子送到大脑——通过疫苗、病毒载体或者输血等方式。
与酶靶点药物相似,疫苗也在长久沉寂之后焕发生机。首个抗淀粉样蛋白疫苗在2002年被叫停,当时在部分受试者中观察到了大脑炎症反应。
现在有几个抗Tau和抗淀粉样蛋白的疫苗在准备阶段或已进入早期临床试验。这些疫苗是Tau或β淀粉样蛋白片段,经挑选和包装以避免严重炎症反应。它们设计用来激活大脑免疫系统识别和破坏完整蛋白,主要目的是预防疾病、延缓早期疾病进展。科学家们还想“一石二鸟”,努力研发同时攻击Tau和β淀粉样蛋白的疫苗。
另一些研究者押宝在基因疗法上,治疗由基因突变导致的阿尔兹海默症。
APOE基因编码一种参与脂质代谢的蛋白,不同形的蛋白会以不同方式影响阿尔兹海默症患病风险。等位基因APOE4与患病风险提高有关,而等位基因APOE2则会降低该风险。在开放标签试验中(所有受试者都接受治疗),纽约市Lexeo Therapeutics公司招募了15名志愿者,所有受试者都表现出轻度阿尔兹海默症症状并携带2个APOE4基因拷贝。Lexeo Therapeutics想检测提供APOE2 基因变异能否降低高患病风险变异带来的致病影响。所以他们把基因置入病毒载体,直接将其注射到志愿者的脑脊液中。
这样的基因移植看起来已经取得些许成功。Lexeo去年报道称,在注射后长达一年内,部分受试者脑脊液中已检测出了APOE2 基因,且目前没有观察到严重的副作用,以及受试者的Tau蛋白水平在逐渐下降。现在评估疾病进展延缓程度还为时尚早,他们会持续监测受试者至2028年。
基因治疗不会人人适用,因为已知的基因突变只导致了很小一部分阿尔兹海默症病例。但替代治疗的概念其他人也在应用。加州Alkahest公司已经完成了一项小型临床试验,检测年轻人的血液因子能否补充衰老过程中丢失的因子[7]。
有些研究者发现科技含量不那么高的方法也有所成效。一项大型、严格对照的临床试验显示,轻度认识障碍患者有氧运动或拉伸18个月能延缓认知功能下降速度,这表明接受药物治疗的同时保持锻炼仍有价值。
要说哪种新治疗方法会脱颖而出还为时尚早。多数研究者认为治疗需要个体化:不同疾病阶段的患者需要不一样的治疗方法。Aisen说:“能看到有这么多看起来可靠的方法真好,但我们前路还长。”
Sperling说,进入临床试验的治疗方法范围这么广,这很振奋人心。“一线成功的微光驱动着我们前进。”
参考文献:
1. Van Dyck, C. H. et al. N. Engl. J. Med. 388, 9–21 (2023).
2. Imbimbo, B. P., Balducci, C., Ippati, S. & Watling, M. Neural Regen. Res. 18, 117–118 (2023).
3. Aisen, P. S. et al. J. Prev. Alzheimers Dis. 8, 306–312 (2021).
4. Bazzari, F. H. & Bazzari, A. H. Molecules 27, 8823 (2022).
5. McDade, E. et al. Nature Rev. Neurol. 17, 703–714 (2021).
6. Rynearson, K. D. et al. J. Exp. Med. 218, e20202560 (2021).
7. Hannestad, J. et al. J. Alzheimers Dis. 81, 1649–1662 (2021).
原文以Conquering Alzheimer’s: a look at the therapies of the future标题发表在2023年4月4日《自然》的新闻特写版块上 © nature doi: 10.1038/d41586-023-00954-w
本文来自微信公众号:Nature Portfolio (ID:nature-portfolio),作者:Alison Abbott