

扫码打开虎嗅APP
本文来自微信公众号:生物学霸 (ID:ShengWuXueBa),作者:UucyLee,编辑:GrayPlus,头图来自:视觉中国(2023年诺贝尔生理学或医学奖获得者Katalin Karikó和Drew Weissman)
北京时间 2023 年 10 月 2 日,瑞典卡罗琳医学院宣布,将 2023 年诺贝尔生理学或医学奖授予 Katalin Karikó 和 Drew Weissman 以表彰他们在“关于核苷碱基修饰的发现,使开发针对 COVID-19 的有效 mRNA 疫苗成为可能”。

图片来源:诺奖官网
德鲁克、哈贝纳和霍尔斯特的开创性研究催生了一门全新的学科——古基因组学。通过揭示所有活着的人类与已灭绝的人类之间的遗传差异,他的发现旨在探索是什么使我们成为独特的人类。
一、学者简介
Katalin Karikó于1955 年出生于匈牙利索尔诺克。她于1982年从塞格德大学获得博士学位,并在1985 年之前在匈牙利科学院塞格德分部进行博士后研究。然后,她在费城的庙大学和健康科学大学进行博士后研究。1989年,她被任命为宾夕法尼亚大学助理教授,一直任职到2013年。此后,她成为 BioNTech RNA Pharmaceuticals 的副总裁,后来晋升为高级副总裁。自 2021 年以来,她一直担任塞格德大学教授,并担任宾夕法尼亚大学佩雷尔曼医学院的兼职教授。
Drew Weissman 于 1959 年出生在美国马萨诸塞州莱克星顿。他于 1987 年从波士顿大学获得医学博士和博士学位。他在哈佛医学院贝斯以色列德肯斯医学中心进行了临床培训,并在美国国立卫生研究院进行了博士后研究。1997 年,韦斯曼在宾夕法尼亚大学佩雷尔曼医学院建立了自己的研究小组。他是疫苗研究的罗伯茨家族教授和宾夕法尼亚大学 RNA 创新研究所的所长。
二、研究内容
这两位诺贝尔奖得主的发现对于在 2020 年初开始的大流行病期间开发有效的 mRNA 疫苗至关重要。通过他们的开创性发现,彻底改变了我们对 mRNA 如何与免疫系统相互作用的理解,这些奖得主在人类健康面临的最大威胁之一的疫情期间,为疫苗的开发速度创造了前所未有的纪录。
疫情之前的疫苗刺激形成对特定病原体的免疫反应。这使得在后期暴露于疾病时,身体能够提前开始对抗疾病。基于杀死或削弱病毒的疫苗长期以来一直可用,例如针对小儿麻痹症、麻疹和黄热病的疫苗。1951 年,马克斯·泰勒因为开发黄热病疫苗而获得诺贝尔生理学或医学奖。
近几十年来,由于分子生物学的进展,基于单个病毒成分而非整个病毒的疫苗得到了开发。通常利用病毒遗传密码的一部分,编码在病毒表面上发现的蛋白质,制造刺激形成抗病毒抗体的蛋白质。例如针对乙型肝炎病毒和人乳头瘤病毒的疫苗。或者,可以将病毒遗传密码的一部分移植到无害的载体病毒上,即“载体”。这种方法在针对埃博拉病毒的疫苗中使用。当注射载体疫苗时,选择的病毒蛋白质在我们的细胞中产生,刺激对目标病毒的免疫反应。
生产整个病毒、蛋白质和载体疫苗需要大规模的细胞培养。这个资源密集型的过程限制了在爆发和大流行病期间快速生产疫苗的可能性。因此,研究人员长期以来一直试图开发独立于细胞培养的疫苗技术,但这证明是具有挑战性的。
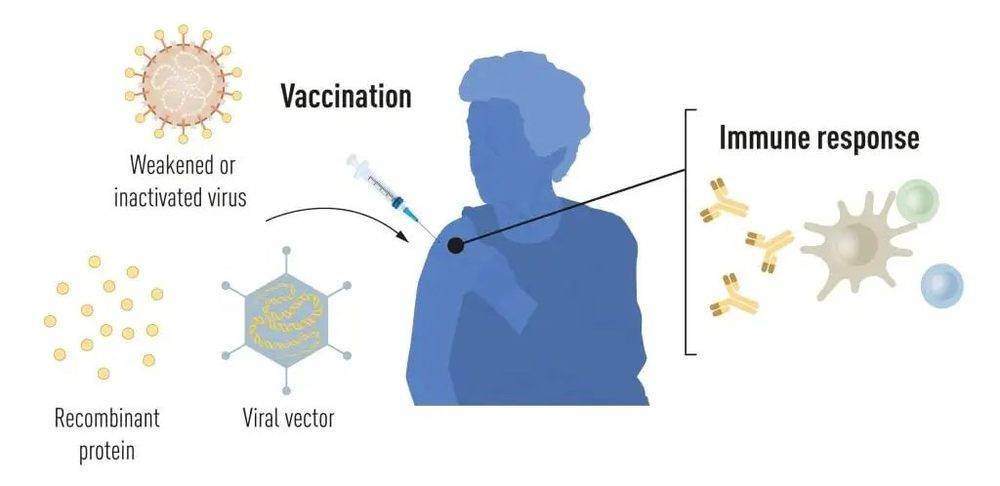
COVID-19 大流行之前的疫苗生产方法。来源:诺贝尔生理学或医学委员会。
三、mRNA疫苗:一个有希望的想法
在我们的细胞中,DNA中编码的遗传信息被转移到mRNA中,作为蛋白质产生的模板。在 20 世纪 80 年代,引入了一种称为体外转录的无细胞培养产生 mRNA 的高效方法。这一决定性的步骤加速了分子生物学在几个领域的应用发展。利用 mRNA 技术进行疫苗和治疗目的的想法也开始兴起,但前方还有障碍。体外转录的 mRNA 被认为不稳定且难以传递,需要开发复杂的载体脂质系统来封装 mRNA。此外,体外产生的 mRNA 会引发炎症反应。因此,最初对开发临床用途的 mRNA 技术的热情有限。
这些障碍并没有让匈牙利生物化学家 Katalin Karikó 灰心,她致力于开发利用 mRNA 进行治疗的方法。在 20 世纪 90 年代初,当她在宾夕法尼亚大学担任助理教授时,尽管在说服研究资助者相信她的项目的重要性方面遇到了困难,但她始终坚持实现 mRNA 作为治疗方法的愿景。
卡里科在大学的新同事是免疫学家 Drew Weissman 。他对树突状细胞感兴趣,这些细胞在免疫监视和疫苗诱导免疫反应中起着重要作用。在新思路的推动下,两人之间很快开始了富有成果的合作,重点研究不同类型的 RNA 如何与免疫系统相互作用。
卡里科和韦斯曼注意到,树突状细胞将体外转录的mRNA识别为外来物质,导致它们的激活和释放炎症信号分子。他们想知道为什么体外转录的mRNA被识别为外来物质,而来自哺乳动物细胞的mRNA没有引起同样的反应。卡里科和韦斯曼意识到,一些关键特性必须区分不同类型的mRNA。
RNA 包含四个碱基,简称A、U、G 和 C,对应于 DNA 的 A、T、G 和 C,即遗传密码的字母。卡里科和韦斯曼知道来自哺乳动物细胞的 RNA 中的碱基经常被化学修饰,而体外转录的 mRNA 则没有。他们想知道体外转录的 RNA 中缺乏改变碱基是否可以解释不受欢迎的炎症反应。
为了调查这个问题,他们产生了不同变体的 mRNA,每个变体的碱基都有独特的化学修饰,并将其传递给树突状细胞。结果令人震惊:当碱基发生修饰时,炎症反应几乎消失。这对我们理解细胞如何识别和响应不同形式的 mRNA 是一个范式转变。卡里科和韦斯曼立即意识到他们的发现对于利用 mRNA 作为治疗方法具有深远的意义。这些重要的结果在 2005 年发表,比新冠疫情爆发早 15 年。
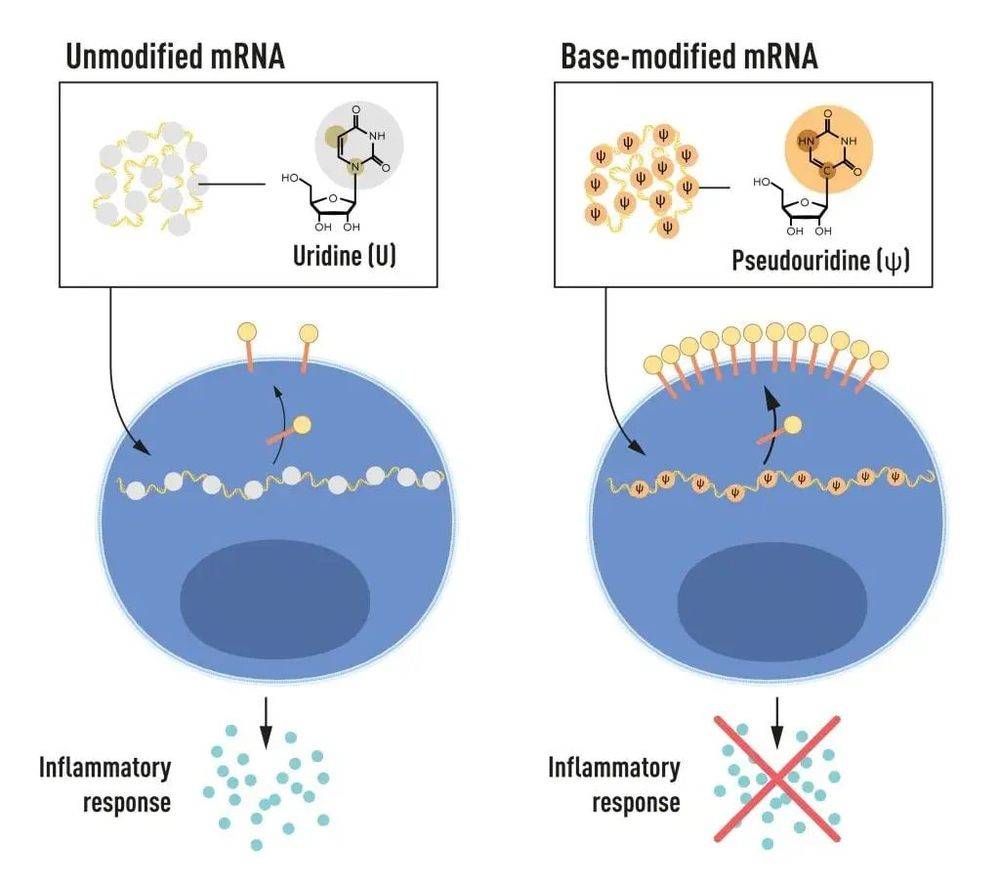
mRNA 包含四种不同的碱基,缩写为 A,U,G 和 C。诺贝尔奖获得者发现,碱基修饰的 mRNA 可用于阻断炎症反应的激活(信号分子的分泌),并在 mRNA 递送到细胞时增加蛋白质的产生。来源:诺贝尔生理学或医学委员会。
在 2008 年和 2010 年发表的进一步研究中,卡里科和韦斯曼表明,与未经修饰的 mRNA 相比,含有碱基修饰的 mRNA 的传递显著增加了蛋白质的产生。这种效应是由于减少了一个调节蛋白质产生的酶的活化。通过他们的发现,碱基修饰既减少了炎症反应又增加了蛋白质的产生,卡里科和韦斯曼消除了 mRNA 临床应用过程中的关键障碍。
四、mRNA 疫苗实现了它们的潜力
对 mRNA 技术的兴趣开始增加,2010 年,几家公司开始致力于开发这种方法。针对寨卡病毒和中东呼吸综合征冠状病毒(MERS-CoV)的疫苗得到了追求;后者与 SARS-CoV-2 密切相关。在 COVID-19 大流行爆发后,以创纪录的速度开发了两种基于碱基修饰的mRNA疫苗,编码 SARS- CoV-2 表面蛋白。报道了约 95% 的保护效果,这两种疫苗早在 2020 年 12 月就获得了批准。
mRNA 疫苗的令人印象深刻的灵活性和速度为将这种新平台用于其他传染病的疫苗铺平了道路。未来,这种技术也可以用于传递治疗性蛋白质和治疗某些癌症类型。
另外,还快速引入了几种基于不同方法的针对 SARS-CoV-2 的疫苗,全球共接种了超过 130 亿剂 COVID-19 疫苗。这些疫苗挽救了数百万人的生命,预防了更多人的严重疾病,使社会得以开放并恢复正常状态。通过他们对mRNA中碱基修饰重要性的基础性发现,今年的诺贝尔奖获得者在我们这个时代最大的健康危机期间对这一变革性发展做出了重要贡献。
最后,再次祝贺以上科学家获得今年的诺奖!
参考文献:
Karikó, K., Buckstein, M., Ni, H.和Weissman, D. Suppression of RNA Recognition by Toll-like Receptors: The impact of nucleoside modification and the evolutionary origin of RNA. Immunity 23, 165–175 (2005).
Karikó, K., Muramatsu, H., Welsh, F.A., Ludwig, J., Kato, H., Akira, S.和Weissman, D. Incorporation of pseudouridine into mRNA yields superior nonimmunogenic vector with increased translational capacity and biological stability. Mol Ther 16, 1833–1840 (2008).
Anderson, B.R., Muramatsu, H., Nallagatla, S.R., Bevilacqua, P.C., Sansing, L.H., Weissman, D.和Karikó, K. Incorporation of pseudouridine into mRNA enhances translation by diminishing PKR activation. Nucleic Acids Res. 38, 5884–5892 (2010).
本文来自微信公众号:生物学霸 (ID:ShengWuXueBa),作者:UucyLee,编辑:GrayPlus
