
扫码打开虎嗅APP

本文来自微信公众号:学术经纬 (ID:Global_Academia),作者:药明康德内容团队,原文标题:《熬夜睡不够,导致致命炎症风暴!张二荃团队〈细胞〉揭示,睡眠不足会过度激活免疫系统》,题图来自:视觉中国
进食与睡眠是动物生存不可或缺的行为,在特殊情况下,动物能保持长时间禁食状态,通过消耗内部储存的糖原或脂肪来维持生命活动,科学地执行禁食甚至还能改善代谢水平。但睡眠却非常不一样,即使只是熬夜或者失眠,第二天精神状态就会急速下降。
从过往的一些研究来看,睡眠不足会对大脑造成显著影响,《神经科学杂志》的一篇论文曾发现,睡眠剥夺会让神经功能紊乱并加速大脑衰老。除此之外,睡眠不足还会减少降低细胞的修复效率,《分子细胞》的一项研究曾表明睡眠状态是DNA损伤修复的高效时段,并且对减少神经元损伤有决定性作用。
本周,在《细胞》杂志上,北京生命科学研究所/清华大学生物医学交叉研究院张二荃研究团队从免疫系统角度揭示了睡眠不足的坏处,研究发现小鼠长时间睡眠剥夺将导致严重细胞因子风暴,并且导致器官衰竭死亡。同时,新研究还揭示了睡眠剥夺导致外周免疫反应的神经分子机制。

此前,哈佛医学院的Dragana Rogulja 团队发现,睡眠剥夺的果蝇在肠道中积累了大量活性氧(ROS),从而显著缩短了睡眠剥夺果蝇的寿命。不过,睡眠剥夺的小鼠肠道ROS含量相较于对照组显著上升,但睡眠剥夺没有导致小鼠死亡,这也说明哺乳动物中的睡眠剥夺机制和影响与果蝇或存在差异。
在新研究中,张二荃团队研究人员发现小鼠肠道ROS的积累与小鼠在睡眠剥夺后免疫反应强度相关,这说明免疫反应激活导致了ROS的产生。更重要的是,为小鼠提供抗氧化剂并不能缓解小鼠睡眠剥夺致死的现象,这些都说明果蝇实验中的结果不能直接推广到哺乳动物中。虽然哺乳动物长时间睡眠剥夺也会致死,但原因与肠道ROS积累无关。
▲研究示意图(图片来源:参考资料[1])
那么睡眠剥夺对小鼠的致死性来自哪里呢?
为了更好地解答这一问题,张二荃实验室研究人员首创了一套适用于小鼠的定名为“Curling Prevention by Water”(CPW)的睡眠剥夺系统,该系统可以持续剥夺小鼠95%以上的睡眠。相较于传统的实验动物转杆睡眠剥夺系统,该系统可以在不引入更多环境刺激和保证实验通量的基础上极大提高睡眠剥夺效率,从而帮助研究人员观察到长时间睡眠剥夺对哺乳动物带来的生理后果。
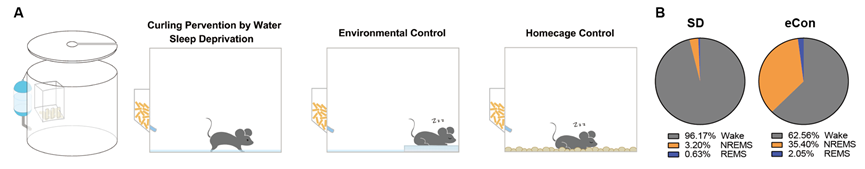
▲Curling Prevention by Water睡眠剥夺系统(图片来源:参考资料[1])
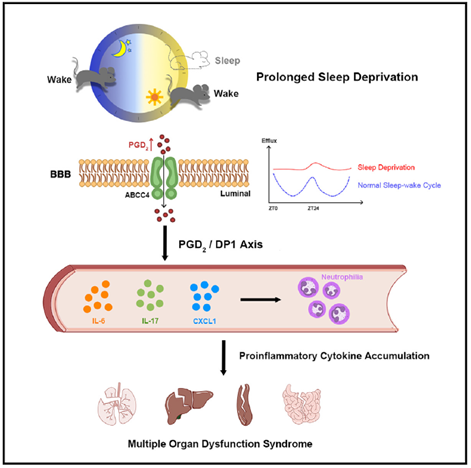
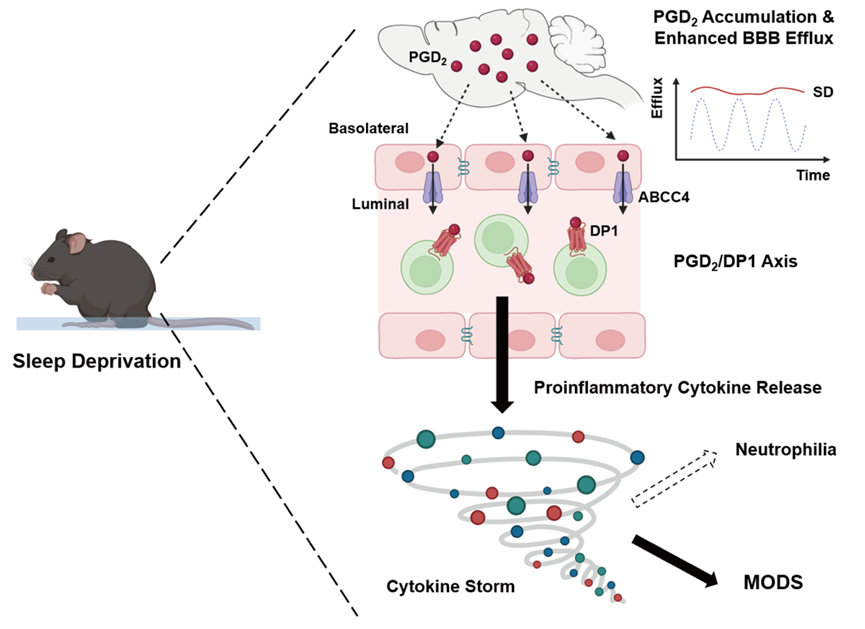
借助全新的CPW系统,研究者对小鼠进行长时间睡眠剥夺时发现,对小鼠进行4天连续睡眠剥夺后,高达70%以上小鼠会死于严重的多器官衰竭。在睡眠剥夺过程中,小鼠血液中的促炎性的细胞因子(如IL-6和IL-17A)和趋化因子(如CXCL1和CXCL2)迅速积累,并将中性粒细胞从骨髓招募到循环系统中,从而导致小鼠出现中性粒细胞增多症。
随着促炎性的细胞因子与趋化因子的持续性积累,小鼠出现由细胞因子风暴诱发的多器官功能障碍综合征(MODS),参与睡眠剥夺实验的小鼠最终都没能存活下来。
▲睡眠剥夺导致细胞因子风暴的通路模型(图片来源:参考资料[1])
不过,在相关研究领域还存在一种说法,睡眠不足会导致个体免疫力下降,从而增加病原体感染风险。那么实验中的小鼠究竟是死于免疫太强还是太弱呢?
研究团队特别选取了一批免疫缺陷的小鼠进行睡眠剥夺实验,如果是免疫力下降,病原体感染引起小鼠死亡,那么免疫缺陷小鼠应该会比预期死亡得更快。但结果却出人意料,长期经历睡眠剥夺的免疫缺陷小鼠并不会死亡。而当普通小鼠经历睡眠剥夺时,给予它们抗细胞因子风暴的药物治疗,可以延长小鼠的存活时间。这些结果都说明,不睡觉导致的死亡真正原因是免疫系统过度激活了。
张二荃教授向学术经纬介绍道,新发现对传统观点来说算是一种有益的补充,“研究用到的是急性(acute)睡眠剥夺模型,和大家平时临时有事情不得不熬夜一样,只不过实验模型将睡眠剥夺做到了极致,甚至出现了细胞因子风暴/致死这种极端表型。但根据实验结果,6小时的睡眠剥夺也会有免疫过度激活/炎症反应(在我们身上就会表现为所谓的‘上火’),用到的分子机制应该是一样的。”
张二荃教授补充道,“还有一种慢性(chronic)睡眠缺失,例如长时间缺觉,就会导致免疫系统受抑制,更容易感染病原微生物。这种在临床表现中也有诸多类似的报道,比如长期失眠会导致抑郁;但是对于无法用药物快速缓解的重度抑郁症患者,有一个办法就是急性睡眠剥夺,一个晚上不睡觉,可以快速脱离那种重度抑郁状态。当然这种方法只是短暂地治标不治本,不过这种现象的分子机制目前我们也还不清楚。”
此外,新研究还揭示出大脑与这种免疫调控有关键联系,睡眠剥夺发生后,小鼠的血脑屏障的主动外排活动会持续增强,如果通过药物抑制这种外排活动,小鼠的免疫反应活动也会随之降低,这也暗示着大脑将一些免疫刺激分子释放到了外周循环系统中。
借助北京大学李毓龙实验室最新开发的GRAB(GPCR activation-based)探针,研究人员发现,睡眠剥夺后PGD2(前列腺素D2)在大脑内积累显著增加。同时,循环系统中PGD2相对稳定的代谢物Tetranor-PGDM含量也显著增加。
此外,睡眠剥夺后PGD2转运到外周循环系统的速度明显提高。在睡眠剥夺实验中,为小鼠提供PGD2受体DP1的拮抗剂,能显著缓和小鼠因睡眠剥夺导致的炎症反应。这些结果也清晰地显示,睡眠剥夺导致的免疫激活反应是由大脑产生到循环系统的PGD2导致的。
张二荃教授表示:“小鼠作为哺乳动物实验模型,对人类的各种行为和生理病理都有很好的借鉴意义。”新研究发现的这一机制,能为解释和解决睡眠不足导致的健康问题奠定了基础,而且有助于深入理解睡眠如何与其他生物学过程相互作用,从而进一步阐释睡眠的功能与意义。
张二荃实验室的桑迪、林可腾,以及北京大学李毓龙实验室的杨旖旎为本文的共同第一作者,张二荃博士为通讯作者。其他作者还包括张二荃实验室的冉光地和陈晨,李毓龙实验室的李柏翰,罗敏敏实验室已毕业博士生卢立辉,他们在各项实验操作中作出了重要贡献;北京生命科学研究所的刘清华博士、李祺博士、马燕博士,北京大学李毓龙博士、刘志博博士、崔希洋博士,北京脑科学与类脑研究所的罗敏敏博士,新桥医院的吕胜青博士等也参与了此项课题。本课题的研究经费受中国科技部、国家自然科学基金委、北京市政府和清华大学支持。
参考资料:
[1] Di Sang et al,. Prolonged sleep deprivation induces a cytokinestorm-like syndrome in mammals. Cell (2023). DOI: 10.1016/j.cell.2023.10.025
本文来自微信公众号:学术经纬 (ID:Global_Academia),作者:药明康德内容团队