
扫码打开虎嗅APP

本文来自微信公众号:生物世界 (ID:ibioworld),作者:王聪,编辑:王多鱼,原文标题:《同期两篇Nature:新型抗生素有望战胜超级耐药菌,已开展人体临床试验》,题图来自:视觉中国
自然界中充满着各种各样的微生物,其中许多对我们的健康发挥着重要作用,例如肠道菌群。但也有不少是严重威胁健康的致病菌,例如结核杆菌(导致肺结核)、霍乱弧菌(导致霍乱)等等。在人类历史上,感染这些致病细菌,除了依赖人体自身的免疫系统,几乎无解。
直到1928年,英国细菌学家弗莱明发现了世界上第一种抗生素——青霉素,让人类第一次有了战胜致病细菌的有力武器。1942年起,青霉素开始大规模生产使用,拯救了无数人,成为提高人均寿命的最大功臣。
然而,抗生素的广泛应用也带来了一个巨大的危机——抗生素耐药性(AMR),抗生素耐药已成为近几十年来全球公共卫生的一个紧迫威胁,其中,碳青霉烯类耐药鲍曼不动杆菌(CRAB)尤为令人担忧,它在世界卫生组织重点病原体清单中位列1类重点,被美国疾病控制与预防中心列为紧急威胁。
鲍曼不动杆菌(A. baumannii)是一种革兰氏阴性菌,它有一层含脂多糖(LPS)的外膜,能抵抗多种抗生素的渗透,因而难以杀灭。阻断脂多糖合成及其向外膜的转运,能降低细胞的生存能力,提高其对某些抗生素的敏感性。
2024年1月3日,罗氏制药和哈佛大学的研究人员在 Nature 期刊同期发表了两篇论文【1、2】,报道了一种新型抗生素作为临床候选药物的发现和开发,这种新型抗生素是一种栓系大环肽(tethered macrocyclic peptide),称为zosurabalpin,能够有效对抗超级耐药菌碳青霉烯类耐药鲍曼不动杆菌(CRAB)。

碳青霉烯类耐药鲍曼不动杆菌(CRAB)已成为全球主要病原体,但其治疗选择有限。50多年来,没有对鲍曼不动杆菌具有抗菌活性的新的抗生素化学类型上市。在第一篇 Nature 论文中,研究团队对碳青霉烯类耐药鲍曼不动杆菌(CRAB)具有强效抗菌活性的栓系大环肽类抗生素进行了鉴定和优化。

这类分子的抗菌作用机制是,阻断革兰氏阴性菌用于转运外膜脂多糖的蛋白质机器复合物LptB2FGC,从而阻断细菌脂多糖从内膜向外膜的运输。从栓系大环肽衍生的临床候选药物zosurabalpin(RG6006)在体外细胞和小鼠感染模型中有效地治疗了高度耐药的CRAB分离菌,绕过了其对现有抗生素的耐药机制。

zosurabalpin通过抑制LptB2FGC功能杀伤细胞
这种抗生素化学类型代表了一种有前途的治疗模式,可用于目前治疗选择不足的CRAB侵袭性感染患者,并进一步确定LptB2FGC作为抗菌药物开发的可行靶点。
革兰阴性菌非常难以杀死,因为它们的胞质膜被一层外膜包围,阻断了大多数抗生素的进入,外膜的不可穿透性是由于其中存在一种大型两亲性糖脂——脂多糖(LPS)。外膜的组装需要将LPS通过从胞质膜到细胞表面的蛋白质桥进行运输。维持外膜的完整性对于细菌细胞的生存至关重要,而其破坏可能会增加对某些抗生素的敏感性。
因此,长期以来一直寻找形成这种跨膜转运蛋白的七种脂多糖转运(Lpt)蛋白的抑制剂。最近发现了一类新的针对鲍曼不动杆菌中LPS转运机制的抗生素。
在第二篇 Nature 论文中,研究团队检查了这类抗生素的活性机制,表明它们以底物结合状态捕获脂多糖运输复合物,使之难以转运脂多糖,最终导致细胞死亡。

在这项研究中,研究团队使用结构、生化和遗传方法,表明这些抗生素捕获了LPS转运蛋白的底物结合构象,从而使该LPS转运机制失效。这些抑制剂通过识别由Lpt转运体及其LPS底物组成的复合结合位点来实现这一目标。这项研究确定了一种不寻常的LPS转运的抑制机制,揭示了Lpt转运体的可成药构象,并为将这一类抗生素扩展到其他革兰阴性病原体提供了基础。
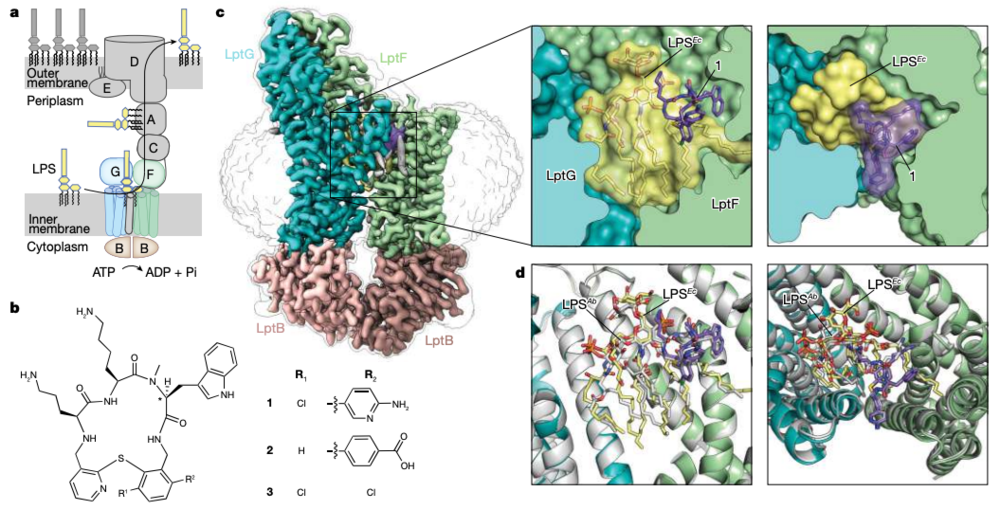
大环肽通过与内膜复合物结合来阻断L脂多糖的转运
总的来说,这两项研究表明,这种新化合物zosurabalpin在应对高度耐药病原CRAB中展现出前景,目前正在进行人体临床试验,以深入开发这一化合物的临床应用。这些研究还识别出了脂多糖转运体的一个特定构象,可作为成药靶标,以开发类似化合物来定向针对其他革兰氏阴性菌。
论文链接:
1. https://www.nature.com/articles/s41586-023-06873-0
2. https://www.nature.com/articles/s41586-023-06799-7
本文来自微信公众号:生物世界 (ID:ibioworld),作者:王聪,编辑:王多鱼