
扫码打开虎嗅APP

本文来自微信公众号:BioArt(ID:BioGossip),作者:王肖,点评:康建胜(郑州大学第一附属医院)、周大鹏(同济大学),责编:迦溆。
D-Mannose,图片引自:https://commons.wikimedia.org/wiki/File:D-Mannose.svg
许多肿瘤都会出现代谢变化,尤其是葡萄糖摄取增加【1】。葡萄糖是己糖(属于单糖)的一种,那么肿瘤是否对己糖家族中的其它成员也有类似反应呢?2018年11月22日,来自英国癌症中心的Kevin Ryan团队解答了这一疑惑,相关研究发表在了Nature期刊上,标题为 Mannose impairs tumour growth and enhances chemotherapy【2】。

研究者首先检测了不同种类己糖包括甘露糖(Mannose)、半乳糖(Galactose)、果糖(Fructose)、岩藻糖(Fucose)、葡萄糖(Glucose)对不同肿瘤细胞株生长的影响(使用浓度为25 nM),发现甘露糖表现出明显的抑制效果(图1)。
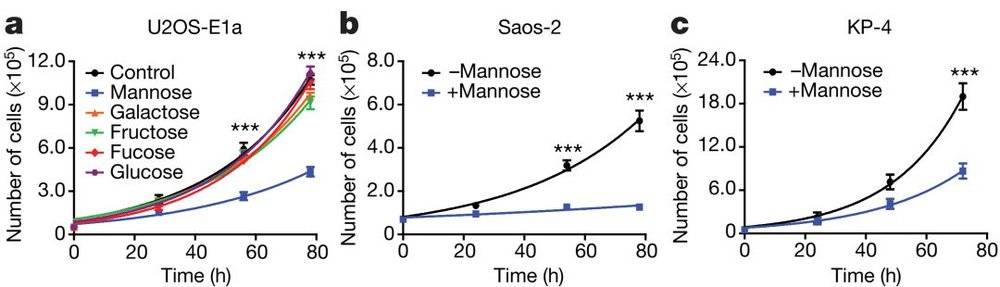
图1:不同单糖对不同肿瘤细胞株生长的影响,其中甘露糖对肿瘤的抑制效果最显著
细胞中参与甘露糖的转运体与葡萄糖是一样的(图2),那么甘露糖的摄取是否影响了葡萄糖的摄取呢?研究者带着这一疑问,研究人员首先发现了甘露糖可以增加AMPK的磷酸化水平(甘露糖诱导AMPK的激活不依赖于AMP或ATP的变化,而是与果糖-1,6-二磷酸的水平有密切关系,这一点很好的证实了林圣彩教授团队2017年在Nature上发表的重要成果,详见:林圣彩组Nature破解葡萄糖感受的新机制【专家特评】),进而发现甘露糖可以增加Hexoses-6-phosphate,同时相反甘露糖并没有影响葡萄糖的摄取反而增加细胞内葡萄糖的含量,而这一现象在其它己糖中并不存在。
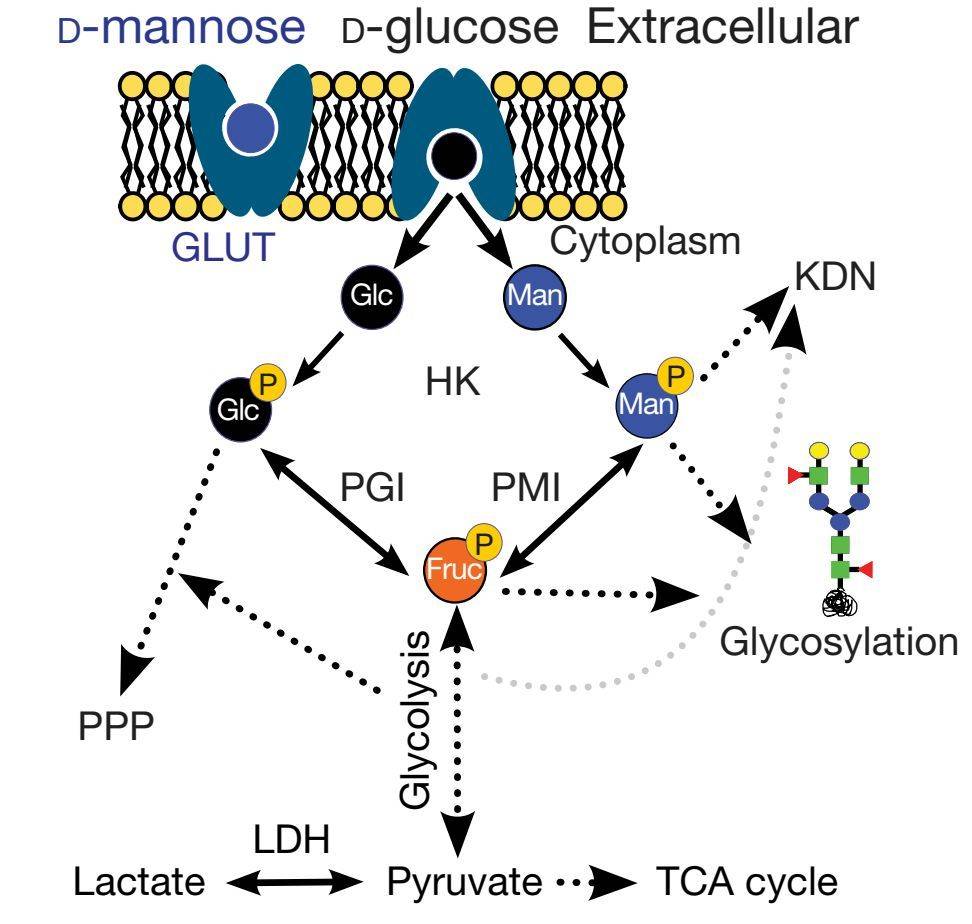
图2:甘露糖与葡萄糖的代谢途径
既然甘露糖并没有影响葡萄糖的摄取,那么甘露糖是如何影响肿瘤细胞生长的呢?研究者发现甘露糖-6-磷酸可以抑制参与葡萄糖代谢的三种酶:己糖激酶、磷酸葡萄糖异构酶(PGI)和葡萄糖-6-磷酸脱氢酶(hexokinases,phosphoglucose isomerase (PGI)和glocose-6-phosphate dehydrogenase),进而影响了三羧酸循环、磷酸戊糖途径及聚糖合成。同样这一代谢抑制在其它单糖中也不存在。由此得出结论甘露糖的摄取可以影响细胞内葡萄糖的代谢。
既然甘露糖可以通过抑制葡萄糖的代谢来影响肿瘤细胞生长,那么甘露糖是否可以影响肿瘤细胞对于化疗药物的反应呢?实验表明甘露糖确实可以增加由顺铂或阿霉素引起的肿瘤细胞凋亡,而其他己糖无此效果。进而研究者利用CRISPR–Cas9的方法,发现了上述甘露糖是通过BAX和BAK的内源途径来影响凋亡的。
上述实验均是利用肿瘤细胞株在体外进行的,那么甘露糖在体内是否也有同样的效果呢?研究者利用体内成瘤实验构建带瘤小鼠,然后通过饲管(一周三次)和饮水(持续性地)让肿瘤小鼠服用甘露糖,发现甘露糖并不影响小鼠的体重和健康,但是却可以明显抑制肿瘤的生长。此外,在体内甘露糖可以增加阿霉素的抗癌效果,并可明显延长小鼠的生存期(图3)。
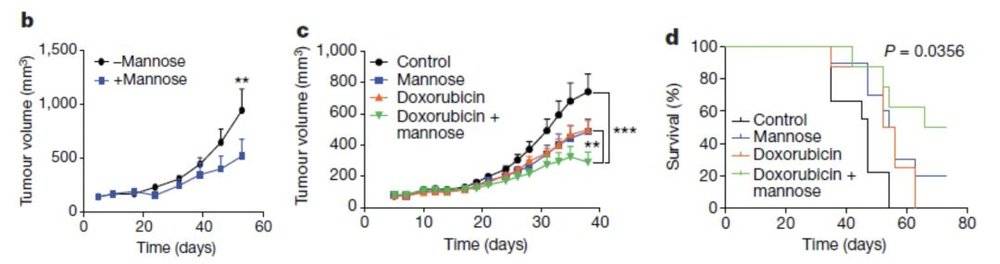
图3:在体内甘露糖可以抑制肿瘤生长,增加阿霉素抗癌效果和延长小鼠生存期
无论在体外还是体内,甘露糖都表现出了明显的抑癌效果,那么是否在所有的肿瘤中都有类似作用呢?既然甘露糖可以影响代谢,那么糖代谢中的某个酶是否和甘露糖的抑癌效果相关?研究者发现PMI(该酶可以催化甘露糖-6-磷酸和果糖-6-磷酸的相互转化,phosphomannose isomerase)【1】与甘露糖敏感性呈现负相关。于是研究者在对甘露糖不敏感的三个肿瘤细胞系(SKOV3,RKO和IGROV1)中敲低了MPI(编码PMI的基因),发现在甘露糖处理后生长均受到了抑制,在甘露糖和化疗药物共同处理时凋亡增加。相反在对甘露糖敏感的细胞系中过表达MPI可以明显抑制甘露糖的效果。
MPI在体内是否也有同样的反应呢?随后研究者利用小鼠和体内成瘤实验证明了MPI敲除的细胞确实增加了对甘露糖的敏感性。
接下来,研究者利用组织芯片的方法检测了人不同肿瘤包括卵巢癌、肾癌、乳腺癌、前列腺癌和结直肠癌中的PMI表达情况,发现不同肿瘤中PMI的表达情况不一样,同时即使是同样的肿瘤表达也有所区别。其中PMI在结直肠癌的表达最低,因此意味着结直肠癌可能对甘露糖敏感。因此研究者利用两种结直肠癌小鼠模型进行甘露糖处理,发现肿瘤生长都受到了明显的抑制。
总的来说,该项研究表明单独服用单甘露糖或结合化疗药物服用可以抑制肿瘤生长。甘露糖疗法可能是一种简单又安全的靶向肿瘤生长的方法。但是仍然需要进一步研究加以验证。
值得一提的是,去年7月份,由美国国立卫生院的华人科学家陈万军教授等发表在Nature Medicine上的一篇文章显示,D-甘露糖可以调控调节性T细胞(Treg)进而抑制自身免疫疾病【4】。

专家点评
01
康建胜 (郑州大学第一附属医院教授)
甘露糖是葡萄糖的同分异构体,C-2 位羟基差向异构体,体内可与葡萄糖相互转换,是参与糖基化修饰的一种主要单糖形式。
本研究利用代谢流技术发现外源甘露糖不影响葡萄糖吸收情况下,通过甘露糖-6-磷酸的富集影响糖酵解、三羧酸循环和磷酸戊糖途径,可以抑制肿瘤的体外和体内的生长,而且肿瘤细胞的甘露糖敏感性和磷酸甘露糖异构酶(PMI)的表达呈负相关性。葡萄糖的其它同分异构体或类似物,如果糖、半乳糖和岩藻糖,没有类似现象和作用。此次的研究报道非常有借鉴意义,尤其在免疫疗法当前过热的阶段,提示了代谢干预癌症治疗的可行性及某种程度的安全性,尤其天然小分子库依然有待人们深入挖掘和探索。甘露糖做为葡萄糖的同分异构体,C-2 差向异构体,结构上微妙的差异和对肿瘤的抑制作用,不免让人想起一个古老的问题:同手型(Homochirality)问题,即生命体基本都使用左旋氨基酸和右旋糖。当然越来越多的证据表明大脑可以利用右旋的氨基酸,比如 D-serine。如果考虑手性和各种差向异构体,可供发掘的代谢小分子数目相当可观。
本研究展示了甘露糖影响代谢的全景图及其作用,但尚未深入研究甘露糖参与的糖基化修饰及其变化情况。随着质谱技术和纳米孔新方法的发展和应用,精细探讨相关蛋白质组及其修饰组学成为可能,期待更多丰富的信息!
02
周大鹏 (同济大学医学院,教授)
为什么导致遗传性糖基化缺陷Ib疾病的基因会调节外源性甘露糖对肿瘤细胞的杀伤?
葡萄糖转运蛋白在肿瘤高表达,是机制明确的诊断靶点,8-氟脱氧葡萄糖-正电子发射计算机断层扫描(8Flurodeoxyglucose-positronemission tomography ,FDG-PET) 是判断肿瘤分级分期和转移情况的最得力的武器之一。作为治疗靶点的尝试,国内外以葡萄糖转运蛋白为靶点,设计了类似葡萄糖的单糖类似物,并与抗肿瘤药物如铂类偶联后形成药物前体。因为肿瘤细胞高表达葡萄糖转运蛋白,比正常细胞更高浓度地摄取单糖类似物-偶联药物,从而提高杀伤肿瘤细胞的特异性【5,6】。
Gonzalez等发现未经修饰的外源性甘露糖经过葡萄糖转运蛋白进入细胞后,可以提高胞浆内Mannose-6-phosphate的浓度,干扰糖代谢通路,引起肿瘤细胞能量衰竭,而直接抑制肿瘤生长。更重要的是,Gonzalez等的发现提示Mannose-6-phosphateisomerase 是一个新的潜在药物靶点。敲除Mannose-6-phosphateisomerase 后,甘露糖对肿瘤细胞的毒性显著提高【7】。
Mannose-6-phosphate isomerase 是催化 fructose 6-phosphate (F6P) 和mannose-6-phosphate (M6P) 互相转化的异构酶。 Mannose-6-phosphate 和 GTP 反应后生成 GDP-mannose,是体内N-糖基化的必需的核苷酸糖。该酶的缺失导致广泛的蛋白N-糖基化缺陷【8】。Mannose-6-phosphateisomerase基因突变的患者归类于遗传性糖基化缺陷Ib 型(CongenitalDisorder of Glycosylation Type Ib),表现为低血糖,血栓形成,蛋白丢失性肠病。这类病人的N-糖基化缺陷可以通过饮食补充外源性甘露糖得到部分纠正。然而,给这类病人静脉注射补充外源性甘露糖时,会诱发昏迷和抽搐,推测其机制为高浓度的细胞内甘露糖在Mannose-6-phosphateisomerase基因突变的情况下,抑制糖代谢通路并导致细胞能量衰竭【9】。因此,选择性地抑制肿瘤细胞Mannose-6-phosphate isomerase 酶,将提高外源性甘露糖治疗肿瘤的疗效和安全性。
外源性甘露糖对肿瘤细胞的杀伤作用是一个令人惊讶的发现,也再次说明在糖类的生物学这个新兴领域,我们的认知是如此之少。糖类相关的抗肿瘤机制和药物靶点将带来与蛋白和基因研究并列的医学突破。
BioArt编后记:
普通的甘露糖虽然在《生物化学》教材上看上去十分不起眼,但是就是这么不起眼的己糖最近焕发出了新的活力。这篇Nature中的实验可能绝大多数生物实验室都能去做,但是此前为什么这么长时间无人问津?相比之下,葡萄糖不要太火。这篇文章有意思的地方并不只是抑制肿瘤这一方面,笔者认为更有意思的是,现在看来己糖中甘露糖和葡萄糖某种意义上功能恰好相反,在激活AMPK信号上完美互补,这也许就是细胞生命活动中应对外部变化时其平衡的美妙之处!
参考文献
1. Pavlova, N. N. & Thompson, C. B. The emerging hallmarks of cancer metabolism. Cell Metab. 23, 27–47 (2016).
2. Pablo Sierra Gonzalez & Kevin M. Ryan. Mannose impairs tumour growth and enhances chemotherapy. Nature. (2018)
3. Sharma, V., Ichikawa, M. & Freeze, H. H. Mannose metabolism: more than meets the eye. Biochem. Biophys. Res. Commun. 453, 220–228 (2014).
4. Zhang, D., Chia, C., Jiao, X., Jin, W., Kasagi, S., Wu, R., ... & Chen, Q. (2017). D-mannose induces regulatory T cells and suppresses immunopathology. Nature medicine, 23(9), 1036.
5.Ma J, Liu H, Xi Z, Hou J, Li Y, Niu J, Liu T, Bi S, Wang X,Wang C, Wang J, Xie S, Wang PG. Protected and De-protected Platinum(IV)Glycoconjugates With GLUT1 and OCT2-Mediated Selective Cancer Targeting:Demonstrated Enhanced Transporter-Mediated Cytotoxic Properties in vitro and invivo. Front Chem. 2018 Sep 21;6:386.
6. Gao X, Liu S, Shi Y, Huang Z, Mi Y, Mi Q, Yang J, Gao Q. Mechanistic and biological characteristics ofdifferent sugar conjugated 2-methyl malonatoplatinum(II) complexes as new tumortargeting agents. Eur J Med Chem. 2017 Jan 5;125:372-384.
7. Gonzalez et al., Mannose impairs tumour growth and enhances chemotherapy. Nature 2018
8. Westphal V, Kjaergaard S, Davis JA, Peterson SM, Skovby F,Freeze HH. Genetic and metabolic analysis of the first adultwith congenital disorder of glycosylation type Ib: long-term outcome andeffects of mannose supplementation. Mol Genet Metab. 2001 May;73(1):77-85.
9. Schroeder AS, Kappler M, Bonfert M, Borggraefe I, Schoen C,Reiter K. Seizures and stupor during intravenous mannosetherapy in a patient with CDGsyndrome type 1b (MPI-CDG). J Inherit Metab Dis. 2010 Dec;33 Suppl 3:S497-502.
本文来自微信公众号:BioArt(ID:BioGossip),作者:王肖,点评:康建胜(郑州大学第一附属医院)、周大鹏(同济大学),责编:迦溆。