

扫码打开虎嗅APP

本文来自微信公众号:BioArt(BioGossip),作者:滕越、关越,责编:迦溆。头图来自:视觉中国。原文标题为:《Nature|科学家首次利用CRISPR来加速特定基因在哺乳动物中遗传》。
“通常制作同时具有6种遗传修饰的小鼠需要大概5年,而利用基因驱动技术,一年就可以办到。”
在经典遗传学理论中,通过孟德尔定律,亲代等位基因有50%的机会被下一代遗传。2003年,进化生物学家Austin Burt提出了基因驱动(gene drive)理论。一些基因具有自我复制功能,如转座子等,可以利用具有这些功能的元件对目的基因进行改造,这样可以使得后代可以以大于50%的机会偏好性遗传目的基因,随着后代的延续整个群体的基因型都会被改变。即利用超孟德尔遗传(Super-Mendelian inheritance)对生物群体进行遗传学工程改造。这种方法可以改造病原传播群体,比如一些蚊子是疟疾、登革热或寨卡病毒的重要传播源,理论上可以利用这种技术降低疾病的传播率。
近期CRISPR技术的日益成熟加速了基因驱动的发展。CRISPR技术包括gRNA和Cas9两部分,gRNA引导Cas9对目标DNA进行切割产生双链断裂(double strand break, DSB)。细胞利用自身损伤修复功能对DSB进行修复,通常有两种结果:一种是非同源末端连接修复(non-homologous end joining, NHEJ),NHEJ会在DSB位点引入核苷酸的插入和缺失(insertions of deletions, indels)发生效率较高,会造成目的基因功能缺失性突变;另一种是同源重组修复(homology directed repair ,HDR),HDR可以以另一条同源染色体或人工外源序列作为模板,实现定向编辑。基因驱动技术利用了CRISPR的HDR,具体过程见下图。
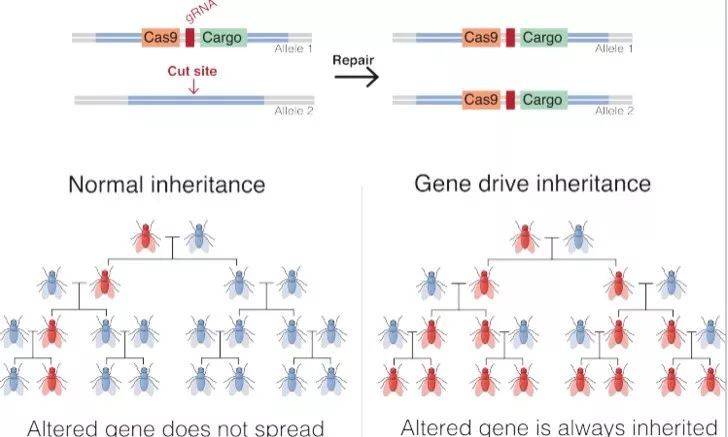
图片来源: 维基百科(Gene drive)
一般情况下,特定突变会以孟德尔方式在群体中遗传。在Cas9和gRNA作用下,通过HDR的机制,杂合型目的基因(在这里标记为Cargo)在个体中趋向于变纯合,从而在遗传中逐步占据优势以至于改变整个群体遗传构成。2014年,来自哈佛大学的科学家们提出了CRISPR应用于基因驱动的想法。2015年,科学家证实了在酵、果蝇和蚊子中, CRISPR可以成功高效地实现基因驱动。但是由于遗传机制的差异,这种系统尚未在哺乳动物中成功开发。基因驱动在哺乳动物中可以用来抵抗有害群体的入侵,也可以用于优化实验动物模型。
1月23日,Nature杂志在线发表了来自加州大学圣地亚哥分校(UCSD)Kimberly Cooper实验室的题为Super-Mendelian inheritance mediated by CRISPR–Cas9 in the female mouse germline的文章,首次在小鼠中成功开发了基因驱动技术。

在这项研究中,作者进行了精细巧妙的实验设计。用CopyCat这段序列插入到酪氨酸酶基因第四个外显子中,造成酪氨酸酶功能失活(TyrCopyCat)。因为白化病是由酪氨酸酶异常引起,这种方法人为造成了小鼠的白化病,可以根据小鼠的毛发颜色来追踪引入的基因突变(下图)。gRNA附近有mCherry的红色荧光标记,理论上成功实现HDR的小鼠中可以追踪到mCherry的表达。

利用CRISPR-Cas9技术在小鼠中实现基因驱动的策略。图片引自:Nature
不同小鼠中分别带有gRNA的目的基因TyrCopyCat和表达Cas9,这样可以灵活控制CRISPR的反应。将这两种品系的小鼠交配繁殖,基因驱动可能在子代中发生。表达Cas9的小鼠的酪氨酸酶第五个外显子上有chinchilla(南美洲栗鼠)的亚等位基因( hypomorphic allele),这种小鼠为灰色。Chinchilla与TyrCopyCat的距离有9.1KB,因此在自然条件下,这两个标记间几乎不会发生交换重组。这种实验条件下,理论上交配后会产生三种等位基因(下图),一种是没有发生CRISPR介导的基因表型改变,只有chinchilla,这种基因作为显性存在时小鼠毛发为灰色;一种是发生了CRISPR介导的基因表型改变,但是只有NHEJ过程,因为造成了酪氨酸酶的功能缺失,这种等位基因为显性时,小鼠为白色,但会在酪氨酸酶上检测到indels; 还有一种是发生了HDR的CRISPR改变,这种等位基因为显性时,小鼠为白色,可以检测到chinchilla、TyrCopyCat和mCherry的同时存在,只有这一种才是基因驱动成功的标志。

作者首先利用Rosa26和H11这两种几乎在所有组织中都能表达的启动子来驱动Cas9,发现这种条件下得到的主要是NHEJ的基因编辑。控制Cas9的表达对实现基因驱动至关重要。作者随后选择了在生殖系中特异表达的启动子来驱动Cas9,因为生殖系中本身会在减数分裂时发生交换重组,抑制NHEJ可能会促进HDR。实验证实这种策略是有效的,在雌性小鼠中,作者可以观察到72%的HDR发生。基因驱动在雌性小鼠中有效,然而在雄性小鼠中尚不成功。
这项研究证实了CRISPR介导的基因驱动在小鼠中应用成功,虽然在将基因驱动用于控制野生小鼠种群之前,还需要开展进一步的工作,但这一研究结果或有助于开发改良小鼠模型,用于研究复杂的遗传疾病。还需要进一步开展工作以增加雄性和雌性小鼠后代的基因遗传频率,但此次研究所实现的效率足以满足很多实验室的应用要求。同期Nature配有相应News & Views文章对此工作进行评论(下图)。

值得一提的是,这项工作在2018年7月被提交到预印本杂志bioRxiv上,当时就引起了主流媒体的强势围观,Nature和Science在都曾讨论过此研究。

在以制作基因修饰小鼠闻名的Jackson laboratory领导技术研发的Michael Wiles评价此项方法是“非常有用的”。因为很多人类疾病是由多种基因引起的,而制作这种小鼠模型要花费大量时间和人力物力。“通常制作同时具有6种遗传修饰的小鼠需要大概5年,而利用基因驱动技术,一年就可以办到。”
来自澳大利亚阿莱德莱大学(the University of Adelaide)的小鼠遗传学家 Paul Thomas称这项研究是“向在哺乳动物中开发基因驱动中迈出的重要的第一步”。Paul Thomas实验室一直致力于开发小鼠中的基因驱动技术来防治啮齿类生物入侵。
同样来自澳大利亚的小鼠遗传学家Gaétan Burgio评价此工作“是非常好的研究同时具有重要的意义”,“我们之前对啮齿类动物中的基因驱动一无所知,我们曾认为它的效率可能跟在果蝇中同样高,但事实并非这样”。
即使这项工作的目的是改造实验动物,来自MIT Mdia Lab的进化生物学家Kevin Esvelt说“令人不安的是,这项工作没有提到保护措施”。他认为如果将基因驱动动物释放到野外的话,需要有个开关来关闭基因驱动的活性并将动物恢复到自然状态。
参考文献:
1. Burt, A. 2003. Site-specific selfish genes as tools for the control and genetic engineering of natural populations. Proceedings. Biological sciences 270: 921-928.
2. Esvelt, K. M., A. L. Smidler, F. Catteruccia, and G. M. Church. 2014. Concerning RNA-guided gene drives for the alteration of wild populations. eLife 3.
3. DiCarlo, J. E., A. Chavez, S. L. Dietz, K. M. Esvelt, and G. M. Church. 2015. Safeguarding CRISPR-Cas9 gene drives in yeast. Nature biotechnology 33: 1250-1255.
4. Gantz, V. M., and E. Bier. 2015. Genome editing. The mutagenic chain reaction: a method for converting heterozygous to homozygous mutations. Science (New York, N.Y.) 348: 442-444.
5. Hammond, A., R. Galizi, K. Kyrou, A. Simoni, C. Siniscalchi, D. Katsanos, et al. 2016. A CRISPR-Cas9 gene drive system targeting female reproduction in the malaria mosquito vector Anopheles gambiae. Nature biotechnology 34: 78-83.
6. Callaway, E. 2018. Controversial CRISPR 'gene drives' tested in mammals for the first time. Nature 559: 164.
7. Cohen, J. 2018. A 'gene drive' makes its debut in mammals. Science (New York, N.Y.) 361: 118.
本文来自微信公众号:BioArt(BioGossip),作者:滕越、关越,责编:迦溆。头图来自:视觉中国。原文标题为:《Nature|科学家首次利用CRISPR来加速特定基因在哺乳动物中遗传》。
Nature原文:Super-Mendelian inheritance mediated by CRISPR–Cas9 in the female mouse germline。