

扫码打开虎嗅APP
本文来自微信公众号:学术经纬 (ID:Global_Academia),作者:药明康德内容团队,原文标题:《难怪久坐容易痴呆!〈科学〉首次发现,大脑里有大量缺氧区,但运动可大幅缓解》,题图来自:视觉中国
我们的生存离不开氧气,而大脑更是身体最需要氧气的器官之一。大脑时刻需要氧气参与的氧化磷酸化反应来生产“能量货币”ATP,维持神经元的活性。
由于大脑无法储存氧气,因此血液必须源源不断地向脑组织供应氧气。一旦大脑内的血液流动中断,短短几秒就会导致意识丧失;当缺氧时间过长,例如在一些卒中、心脏病案例中,患者可能会面临不可逆的神经损伤甚至是脑死亡。
我们知道氧气对于大脑很重要,但就连科学家们也没有弄清楚的是,氧气在整个大脑里是如何动态变化的?或者用专业术语来说,反映大脑中局部氧气水平的指标——脑组织氧分压(pO2)的时空特征是怎样的?
之所以有这样的问题,一个重要原因是技术上的不足:科学界缺乏对氧分压进行高精度成像的工具,因此也就看不清氧气在大脑内的动态细节。
现在,一项发表于《科学》杂志的新研究解决了这一难题。来自转化神经医学中心(由丹麦哥本哈根大学和美国罗切斯特大学合办)的研究团队开发了一款可视化工具,让我们看清了氧分压在小鼠大脑中的动态过程。借助这款全新工具,作者首次发现大脑中存在短暂的缺氧区域。由于运动可以迅速减小缺氧区的面积,因此作者推测,这可能解释了不同生活方式对痴呆风险的影响。

和科学史上的很多重要发现一样,这项研究在一开始也有无心插柳之意。研究团队最初的目的并不是寻找氧分压的监测工具,而是想要借助荧光蛋白来研究大脑中的钙离子浓度。
自从日本科学家下村修从水母中首次鉴定出绿色荧光蛋白以来,这种会发光的蛋白照亮了活体生命的身体内部,也点亮了探索生命过程的道路。
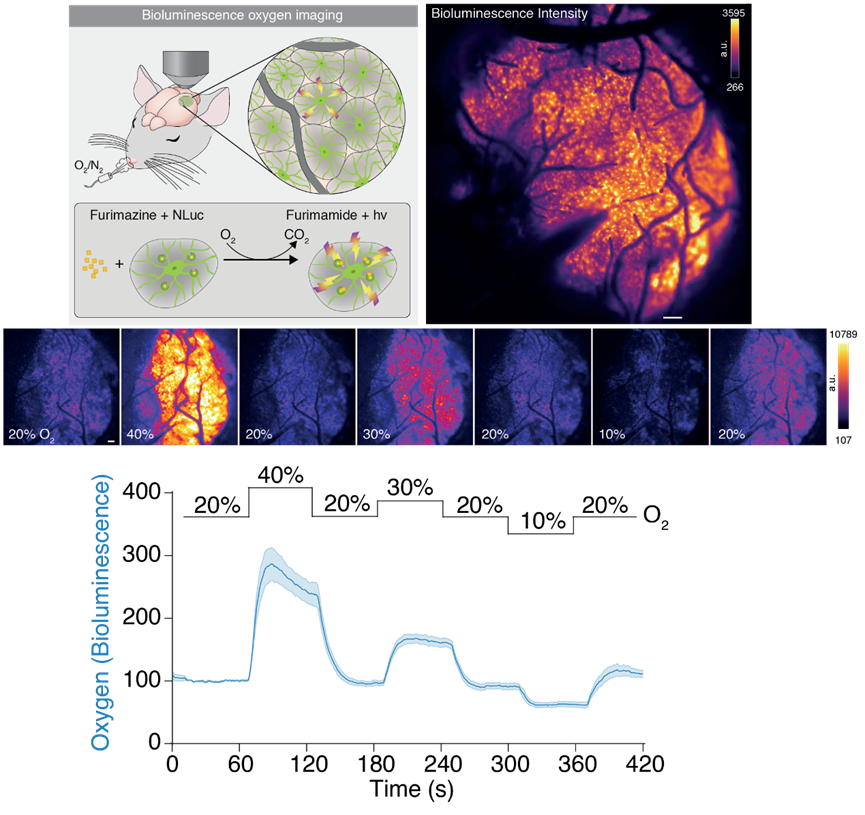
近年来,荧光蛋白工具也经历了一系列改造升级,最新研究使用的就是一种由荧光酶素和荧光蛋白组成的荧光融合蛋白(名为Green enhanced Nano-lantern,简称GeNL)。在荧光素酶的催化作用下,发光底物furimazine发生氧化反应,反应产生的能量就以光的形式释放。
为了测定钙活动,研究团队在小鼠的星形胶质细胞中表达GeNL,并通过开颅手术将底物注射至脑内。不幸的是,他们在实验中遇到了一些挫折:他们拿到的荧光蛋白产品在生产环节出了问题。在等待制造商提供新蛋白的同时,论文第一作者Felix Beinlich博士决定用这批“次品”继续进行实验,用于优化监测系统。
在实验中,Beinlich博士注意到发光的强度出现了波动。这种波动反映出什么样的生理变化?荧光酶素催化底物的反应需要氧气参与,在一定条件下,氧气浓度可以成为这个酶促反应的限速因素。因此作者猜测,荧光强度的变化可能反映了局部的氧气水平,也就是氧分压。
接下来的小鼠实验也证实了这一猜测:在改变小鼠所处环境的氧气浓度后,作者发现生物发光强度的变化与测得的氧分压变化线性相关。因此,GeNL的生物发光强度可以成为准确测定氧分压的指标!作者将其称作基因编码生物荧光氧指示剂。如下方视频所示,利用这款具有优秀信噪比的工具,我们第一次可以从荧光强度中,直接看清氧分压的时空动态变化。
▲视频展示了在不同氧气浓度下的成像结果。生物发光强度随着小鼠呼吸的氧气浓度变化而波动。(视频来源:哥本哈根大学)
这一看,研究团队真的看见了一个前所未见的现象:大脑中一些面积很小的特定区域会变暗,持续的时间从几秒到几分钟不等。荧光强度指示的是局部的氧分压,因此暗区意味着这些区域的氧气供应被暂时切断了。研究团队将其称作“缺氧区”(hypoxic pockets)。在小鼠研究中,同一位置平均每7分钟就会出现一次缺氧区。

▲小鼠呼吸的氧气浓度影响了生物发光强度,图中标注了缺氧区(图片来源:Dan Xue, Felix Beinlich)
我们知道长时间的缺氧会造成大脑损伤,但这些小范围的短暂缺氧区域却是首次被观测到,它们是如何形成的,又会造成怎样的后果?
进一步的研究发现,缺氧区是由大脑中毛细血管的微循环受阻造成的。就和全身其他区域一样,大脑中的循环系统也是通过“干流”动脉网络和渗透脑组织的“支流”毛细血管,共同为脑组织供氧。在细小的毛细血管中,当白细胞短暂地“堵住”管道就会阻止运输氧气的红细胞通过,这时局部脑组织就会进入缺氧状态。
▲毛细血管堵塞导致了缺氧区的形成(图片来源:Felix Beinlich)
毛细血管的堵塞会随着年龄的增长而增加,并且在阿尔茨海默病模型中也观察到这样的现象。这些发现提示,这些缺氧区可能与阿尔茨海默病等痴呆的风险升高相关。
虽然无法完全避免形成这样的缺氧区,但通过改变生活状态,却可以尽可能降低缺氧区的影响。研究发现,相比于静息状态,运动期间小鼠大脑中的缺氧区面积减少了52%。
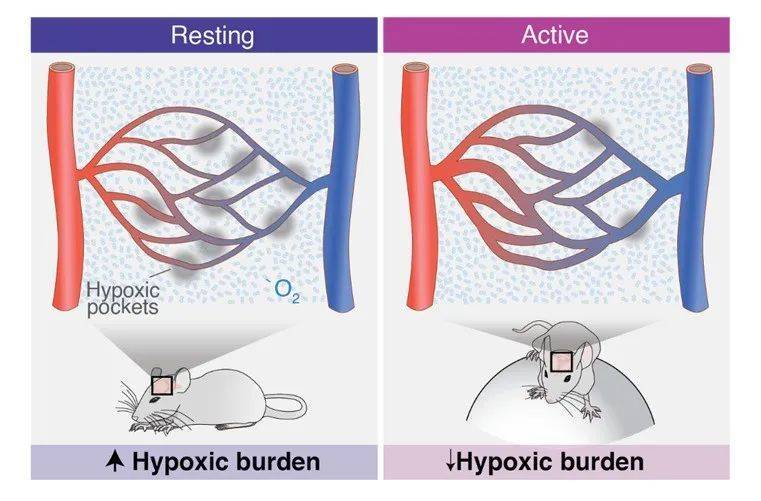
▲静息与运动状态时小鼠缺氧区的对比示意图(图片来源:Dan Xue, Felix Beinlich)
研究论文也写道:“这项研究推测,身体活动不足会促进毛细血管堵塞并增加缺氧区的数量;相反,仅仅增加感觉输入或是运动就能迅速抑制缺氧的发生,这或许可以解释久坐的生活方式与痴呆风险增加之间的联系。”
领导这项研究的Maiken Nedergaard教授也指出,借助这款新工具,“现在可以研究阿尔茨海默病、血管性痴呆等一系列与大脑缺氧相关的疾病,以及久坐的生活方式、衰老、高血压和其他因素如何导致这些疾病。”
参考资料:
[1] Beinlich et al., Oxygen imaging of hypoxic pockets in the mouse cerebral cortex. Science (2024). DOI: 10.1126/science.adn1011
[2] New imaging method illuminates oxygen's journey in the brain. Retrieved Mar. 29, 2024 from https://www.eurekalert.org/news-releases/1038980
本文来自微信公众号:学术经纬 (ID:Global_Academia),作者:药明康德内容团队
