
扫码打开虎嗅APP

本文来自微信公众号:返朴(ID: fanpu2019),撰文:蒋昕(中科院上海生命科学研究院神经科学研究所博士),封面:电视剧《都挺好》
你注意到了吗:随着年龄增长,许多老年人的生物节律会发生紊乱,白天瞌睡晚上醒,或者本来白天好好的,却在日落时分犯起糊涂来。此外,老年人也易患阿尔兹海默病、帕金森病等神经退行性疾病。这些问题有什么内在联系?
地球通过自转和公转产生昼夜分明的二十四小时和四季变化的三百六十五天,地球上的生物也进化出稳定的“生物钟”以适应外界环境中的光照、温度等变化。这种奇妙的生物节律一直是科学家研究的热点。
目前研究人员已利用在不同模式生物中的遗传学筛选,以及对睡眠疾病患者进行基因测序的方式找到了调控节律的关键基因,正是由这些基因构成的网络形成了我们体内看不见的“时钟”。但随着人年龄的增加,这个原本稳定的时钟有时也会慢慢出现毛病,于是有些人会出现节律相关的问题。
除了生物钟的紊乱,伴随衰老而来的还有神经退行性疾病,如阿尔兹海默病(俗称老年痴呆症)和帕金森病等。奇怪的是,有些神经退行性疾病的患者除了出现这些疾病的典型症状如记忆力减退、运动僵直等外,还会出现生物节律的紊乱。且有时节律异常甚至在罹患神经退行性疾病之前好几年,就已出现。
这不禁令人发问,生物节律的紊乱与退行性疾病的发生发展之间是否存在着因果关系?
生物钟的分子零件
2017年诺贝尔生理或医学奖授予了三位在果蝇上找到调控生物钟关键基因的科学家,让更多人知道了像生物节律这样复杂的行为也是由基因控制的。
但追溯到1971年,当加州理工大学的本泽(S. Benzer)教授和他的学生科诺普卡(R. Kanopka)惊讶地发现一个基因(PER)竟能调节果蝇的节律时,本泽教授博士后的导师德尔布鲁克(M. Delbruck)教授却坚定地对他说:“不,我一个字都不相信!”
但在一代又一代科学家的努力下,从果蝇的 Per 基因开始,至今不仅已利用小鼠在哺乳动物中找到十几个调节基因表达的蛋白质是如何构成精细网络来调节生物节律的。

本泽教授和他的巨型果蝇模型。他是将基因带到行为学中第一人,即发现有些行为是由基因决定的。他利用顺向遗传学筛选的方法 (即在模式生物中进行大规模基因突变后,用特定的行为范式进行筛查,得知哪种基因突变会影响对应的行为) 在果蝇中找到与趋光性、生物节律和学习记忆相关的基因。之后其他科学家借鉴这种筛选方法,在小鼠上找到哺乳动物中控制节律的基因。
哺乳动物中,这些核心节律蛋白之间能通过相互作用形成三条负反馈调控通路。而这三条负反馈通路中, 最重要的通路由激活蛋白 BMAL1、CLOCK 和抑制蛋白 PER、CRY 构成。白天,激活蛋白复合体结合在 Per,Cry 基因的启动子(一段能调控基因表达的DNA序列)上,激活 PER、CRY 的表达,其表达量逐渐积累, 到傍晚时达到高峰。
但抑制蛋白 PER、CRY 表达之后, 却反过来通过与激活蛋白复合体结合,来抑制自身的表达,于是 PER、CRY 的含量又在夜晚逐渐降低。到次日清晨,由于数量的减少,PER、CRY 对自身表达的抑制也就被解除了,从而又激活蛋白复合体开启新一轮的调节 ,周而复始 。
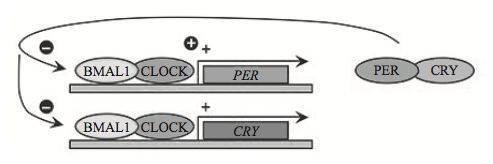
哺乳动物生物钟的重要负反馈通路。激活蛋白复合体 BMAL1 和 CLOCK 作用于编码具抑制作用的 PER、CRY 蛋白的基因启动子上,在白天促进 PER、 CRY 的表达,到夜晚 PER、CRY 蛋白量达到最高峰, 它们又反过来与 BMAL1、CLOCK 蛋白相互结合,作用于自己的启动子区域,抑制自身的表达。
神经退行性疾病中的节律紊乱
神经退行性疾病是由于大脑中某个脑区或某类神经细胞的死亡而造成的一系列疾病。较常见的神经退行性疾病有:影响认知和学习记忆的阿尔兹海默病、额颞痴呆(frontotemporal dementia),以及主要影响运动功能的帕金森病、亨廷顿舞蹈症和肌萎缩侧索硬化(amyotrophic lateral sclerosis,俗称渐冻症)。
神经退行性疾病的治疗目前还是世界性医学难题,对于基础科研工作者来说,对这类疾病致病机制的探索道路还很漫长。所幸的是,这些疾病中有部分患者是家族性遗传的(绝大部分患者是散发性的,即没有家庭遗传背景)。而对于这部分患者,可以通过基因测序得知是什么基因突变引发疾病,进而研究该基因的致病机理和发病机制。
在临床上,一些诊治神经退行性疾病的医生发现了一个奇怪的现象,即部分患者会出现生物节律方面的问题。比如,25%~65% 阿尔兹海默病患者在发病早期到发病期间,伴有不同症状的睡眠障碍,且很多睡眠障碍的产生甚至早于出现阿尔兹海默病的典型认知障碍。
这些患者的睡眠问题包括白天瞌睡增多,晚间失眠且睡眠间断,每天的认知状况随着一天中光线逐渐变暗而变差(日落综合征)等。此外,他们的脑电记录(EEG)显示,快速眼动睡眠和非快速眼动睡眠时间都比对照人群的短。
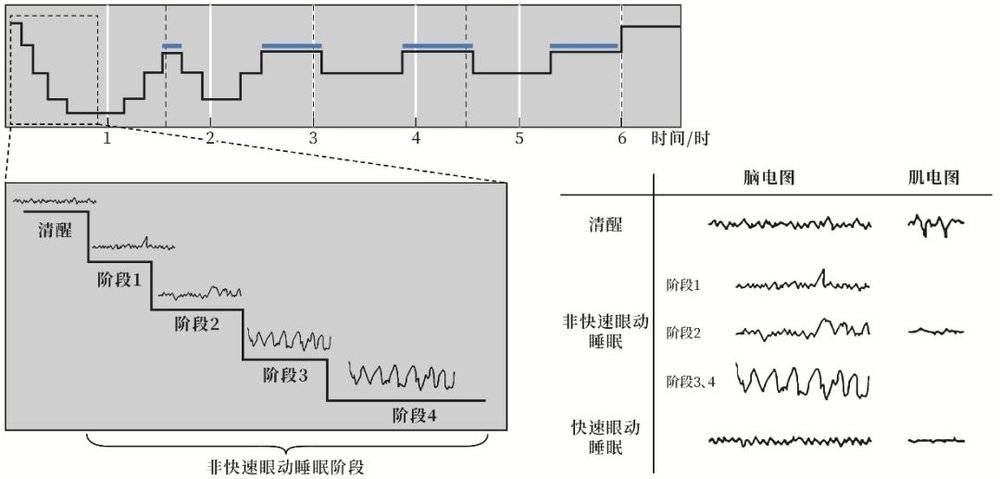
典型的人夜晚睡眠周期图。根据脑电 (EEG) 和肌电(EMG)以及眼动记录 (EOG) 可将睡眠分为非快速眼动睡眠和快速眼动睡眠阶段 (蓝线所示) 。非快速眼动睡眠又分为 4 个阶段。在一晚约 6 小时睡眠中,90~110 分钟 (由竖直虚线分隔) 为一个睡眠周期,不同睡眠阶段在一个周期内依次循环。其中非快速眼动睡眠和快速眼动睡眠的肌电图类似, 但脑电图差别较大;清醒阶段和快速眼动睡眠阶段的脑电图类似但肌电图差异巨大。
除了阿尔兹海默症外,帕金森病患者中睡眠 - 觉醒行为的紊乱还能作为其发病前的重要预测指标之一。据报道,有超过 2/3 的帕金森病患者会出现睡眠问题,其中最严重的是快速眼动睡眠障碍。快速眼动睡眠约占夜晚睡眠总时长的 20%,在这段时间里人们常常会产生逼真的梦境。
但因为正常人的运动中枢在沉睡时是受到抑制的,所以梦永远只是虚无的想象,但快速眼动障碍的患者却失去了对运动的抑制,于是会跟随梦境挥动四肢、扭动身体,甚至会放声呼喊起来。不幸的是,罹患快速眼动障碍的人群比对照人群更容易在未来患上帕金森病。
神经退行性疾病与生物节律紊乱间的关系
许多临床数据已充分说明了不同神经退行性疾病与生物节律之间的相关性,但对于治病救人来说,只知道相关性还远远不够。那么,如何来探究这两者之间的因果关系呢?一条最直接的思路就是,神经退行性疾病的致病基因是否能直接调控生物节律呢?更细化一点地说,这些致病基因能否调控核心节律基因的表达,并当致病基因出现突变后,是否也会让个体产生节律行为的异常呢?
近期的一项研究将关注点集中在一个与两种神经退行性疾病(渐冻症和额颞痴呆)都相关的蛋白 FUS上面。Fus 基因的突变会造成渐冻症,且在患这两种病的一些患者脑中也检测到 FUS 蛋白的异常病理性聚集。 在这两类疾病特别是额颞痴呆患者中也有睡眠异常的报道,但还没有相关分子机制的研究。
一系列分子生化实验发现,FUS 蛋白也能结合在核心节律基因 PER、CRY 的启动子区域,并通过招募有抑制基因表达作用的 PSF-HDAC1 蛋白复合体,进而抑制 PER、CRY 基因的表达。这说明神经退行性疾病的致病基因也能调控核心节律基因的表达[1]。
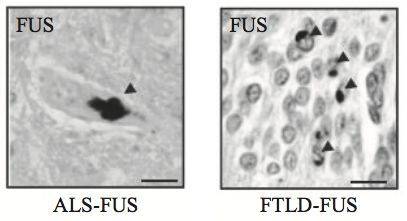
FUS 蛋白在渐冻症和额颞痴呆。患者脑中的异常聚集 (箭头所指) [2]
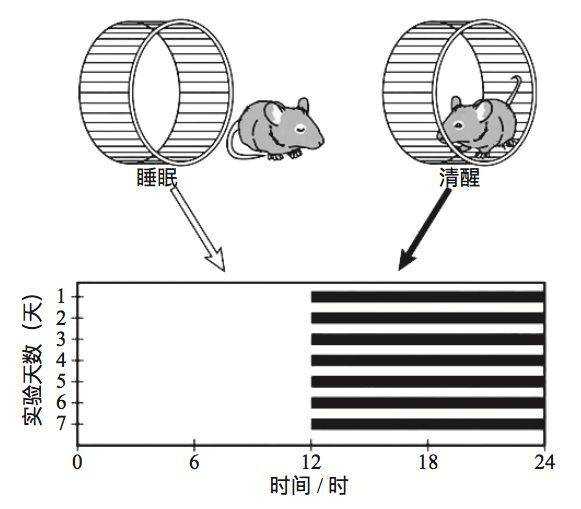
用跑轮实验检测大鼠的生物节律。每只大鼠单笼饲养于一个放置有跑轮的鼠笼内,通过连续长时间记录笼内轮子的转动情况,来表征动物的昼夜节律。
如何研究 FUS 基因的致病突变是否会影响个体的节律行为呢?渐冻症中最常见的 FUS 基因突变使得 FUS 蛋白第521位精氨酸突变为半胱氨酸,这使原本主要分布于细胞核内的 FUS 蛋白更多地分布于细胞质中, 这可能影响 FUS 蛋白在细胞核内行使其调控节律基因表达的功能,从而影响个体的节律行为。
为验证 FUS 突变是否会影响节律行为,研究者使用了有着与人类相似 FUS 蛋白的大鼠作为模式生物,并运用 CRISPR/Cas9 基因编辑技术构建了一个与患者 FUS 蛋白第521位突变相同的 FUS-521 突变大鼠 [3]。
为观察 FUS 突变是否会影响节律,研究者采用经典的跑轮实验来记录大鼠的昼夜运动行为,以表征其生物节律。并通过记录大鼠的脑电检测其睡眠情况。实验结果显示,FUS 突变大鼠的运动节律和睡眠与野生型大鼠相比都出现了异常。这说明突变的致病基因也能影响生物体的正常节律。
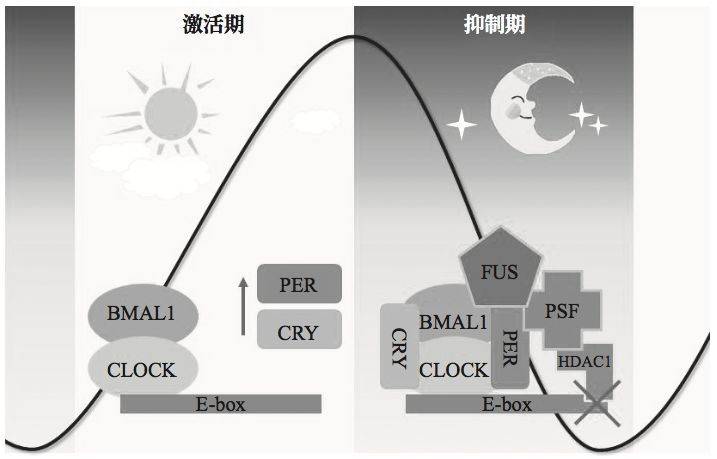
FUS 蛋白调控生物节律的分子机制。FUS 蛋白能将抑制基因表达的 PSF 和 HDAC1 蛋白招募到 PER、CRY 基因启动子区域来抑制 PER、CRY 的表达。
综上所述,一些神经退行性疾病的致病基因会通过调控核心节律基因的表达,来改变生物节律,所以患者中出现的节律症状有可能是突变的致病基因引起的,但对于不同基因都需要用实验进行探究证实。
但更重要的问题是,探索神经退行性疾病患者中的节律紊乱问题与患者更严重的疾病典型症状,如认知障碍、运动异常等有着怎样的关系。如果能对生物节律紊乱症状采取干预,那是否也能对其他典型症状有所缓解。
目前临床上已有针对阿尔兹海默症患者采取光照的治疗手段,即通过强光照射调节其昼夜节律,但这种方法对患者的认知水平是否有帮助,还有待分析。因此,基础科学方面更多关于两者因果关系的探索及临床上针对患者节律紊乱治疗的尝试都是值得努力的方向。
参考文献
[1] Jiang X, Zhang T, Wang H, et al. Neurodegeneration-associated FUS is a novel regulator of circadian gene expression. Translational Neurodegeneration,2018,7: 24-34.
[2] Dormann D, Haass C. TDP-43 and FUS: a nuclear affair. Trends Neurosci, 2011, 34(7): 339-48.
[3] Zhang T, Jiang X, Xu M, et al. Sleep and circadian abnormalitiesprecede cognitive de cits in R521C FUS knockin rats. Neurobiology of Aging, 2018, 72: 159-70.
《返朴》,致力好科普。国际著名物理学家文小刚与生物学家颜宁联袂担任总编,与几十位学者组成的编委会一起,与你共同求索。关注《返朴》(微信号:fanpu2019)参与更多讨论。二次转载或合作请联系fanpu2019@outlook.com。