

扫码打开虎嗅APP
2 月 19 日北京时间凌晨三点,西湖大学周强实验室团队关于成功解析新冠病毒细胞受体结构的重大突破性成果在预印版平台 BioRixiv 上线,在国际上首次解析了 nCov 病毒的受体—ACE2 的全长结构。
此发现为是西湖大学承担的浙江省新型冠状病毒肺炎防治应急科研攻关任务的重要成果,更是抗击新型冠状病毒路程上的里程碑,具有重大意义。
“总体而言,ACE2 全长结构的解析,将有助于理解冠状病毒进入靶细胞的结构基础和功能特征,对发现和优化阻断进入细胞的抑制剂有重要作用”,清华大学全球健康与传染病研究中心主任张林琦教授说。
ACE2 是什么?为什么要解析它?
新型冠状病毒感染引发的肺炎疫情爆发后,ACE2 被鉴定为引起 SARS 冠状病毒也是此次 2019 新冠状病毒的基本受体,而在 SARS 中,ACE2 的下调在病毒感染后严重肺衰竭的发病机制中起着重要作用。
也就是说,新型冠状病毒是通过识别 ACE2 蛋白进入人体细胞的,ACE2 就像是“门把手”,病毒抓住了 ACE2,就打开了进入细胞的大门。因此,ACE2 是“新冠病毒”侵入人体的最开始也是最重要的一环。
在 2003 年后,ACE2 已被鉴定为非典(SARS)冠状病毒感染的一种必需受体,但也是抵抗非典致死性肺衰竭的一种保护性分子。
有趣的是,ACE2 的非典冠状病毒受体功能与其对 Ang II 降解的催化活性在机制上并无关联,而 ACE2 介导的 Ang II 降解对于肺保护免受非典型肺炎发病机制的影响仍然很重要。换句话说,SARS 选择了具有作为肺保护作用的 ACE2 作为受体,让针对 ACE2 的靶向治疗(也就是上一次的假设)进退两难。
而这次,与 SARS 表现特性极为相似的新型冠状病毒再一次把目标锁定在 ACE2 上。但值得注意的是,中国国家疾控中心等研究机构联合发表的近九千例新冠肺炎(COVID-19)确诊病例和疑似病例数据显示,新冠肺炎的基本传染数 R0 则高达 3.77。从传染能力上来说,这次的新型冠状病毒(SARS-CoV-2)要比 SARS 病毒(R0:0.85-3)厉害的多。
那么既然新型冠状病毒与 SARS 病毒都是依赖病毒表面的 S 蛋白与细胞表面的血管紧张素转换酶 2(ACE2)结合,才得以进入细胞,那新型冠状病毒的传染性为什么比 SARS 病毒强呢?
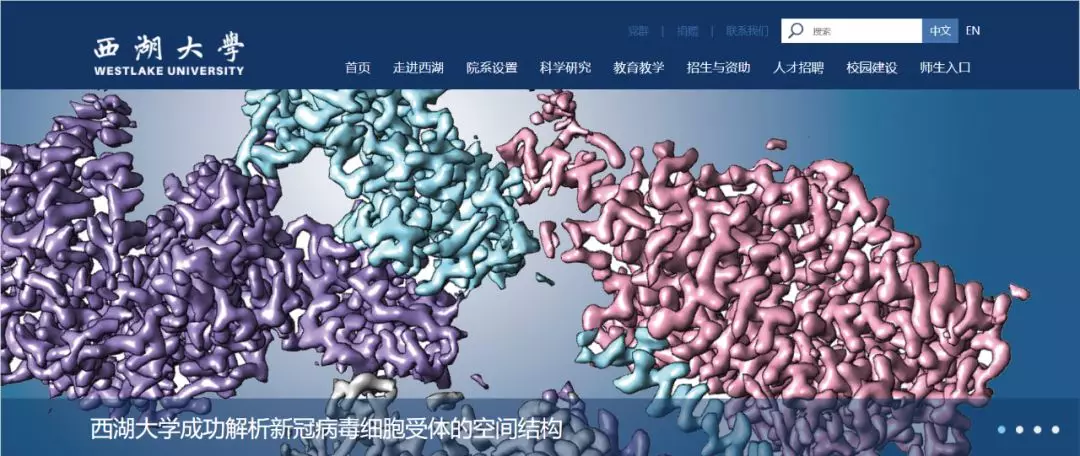
美国德克萨斯大学奥斯汀分校的 Jason S McLellan 团队于 2 月 17 日同样在预印版平台 bioRxiv 发表研究论文,研究人员利用冷冻电镜技术解析了新型冠状病毒的 S 蛋白结构,还利用表面等离子共振技术(SPR)分析了 S 蛋白与 ACE2 的亲和力。
他们发现,ACE2 蛋白与新型冠状病毒的亲和力竟是 SARS 病毒的 10 到 20 倍,而不是之前的比 SARS 病毒弱。
这也解释了为什么新冠病毒的传染性如此之强。为了解析新型冠状病毒的 S 蛋白的结构,McLellan 团队的研究人员首先根据已经公开的基因组序列,合成并纯化了新型冠状病毒 S 蛋白的膜外部分。然后用冷冻电镜给纯化的 S 蛋白拍了 3207 张照片,经过 3D 重建,获得了分辨率为 3.5 Å的 S 蛋白三聚体结构。
通过与 SARS 病毒的结构比较,研究人员发现新型冠状病毒的 S 蛋白与 SARS 病毒的在结构上存在差异,但是整体上看相似度很高。从 S 蛋白的三聚体来看,新型冠状病毒的三聚体更容易与细胞表面的 ACE2 蛋白结合。
更让人惊讶的是,研究人员通过表面等离子共振技术(SPR)分析得到的结果表明,新型冠状病毒 S 蛋白与 ACE2 的平衡解离常数 KD 是 15 nM,而 SARS 病毒 S 蛋白与 ACE2 的平衡解离常数 KD 竟然达到了 325.8nM。而 KD 值越大说明解离越多,S 蛋白与 ACE2 的亲和力越弱。经过计算,新型冠状病毒 S 蛋白与 ACE2 的亲和力,是 SARS 病毒 S 蛋白与 ACE2 之间亲和力 10 倍,甚至 20 倍。

新冠病毒(上)和 SARS 病毒(下)的 S 蛋白与 ACE2 的亲和力比较
在 McLellan 团队的研究人员看来,新型冠状病毒感染人体细胞的关键在于 S 蛋白与 ACE2 蛋白的结合,搞清楚新型冠状病毒 S 蛋白的结构,以及它与 ACE2 之间的相互作用,对于新型冠状病毒的传染作用有着重大意义。
同时,对于 ACE2 受体的蛋白结构解析也成为科研探索的道路上一道关卡。在新型冠状病毒 S 蛋白结构解析成果的基础之上,一个个谜团也扑面而来:
ACE2 到底在细胞膜上是以什么状态存在?新冠病毒对比 SARS 病毒与 ACE2 结合有何异同?
所以,西湖大学的周强实验室团队针对这个问题进行了攻坚,首次成功解析 ACE2,则是研究新型冠状病毒方向上的一个重大突破。
ACE2 结构解析成果汇总
首先,他们需要获得实验样本——ACE2 蛋白全长蛋白,而作为膜蛋白的 ACE2 本身很难在体外稳定获得。

周强
周强及博士后鄢仁鸿在文献中发现 ACE2 与肠道内的一个氨基酸转运蛋白 B0AT1 能够形成复合物。根据他们过去的研究经验,B0AT1 (SLC6A19) 是一种中性氨基酸转运蛋白,其在肠细胞中的表面表达需要 ACE2,因此这个复合物极有可能稳定住 ACE2。
果然,他们通过共表达的方法获得了 ACE2 与 B0AT1 优质稳定的复合物,并利用西湖大学的冷冻电镜平台成功解析了其三维结构,分辨率达到 2.9 埃,对于病毒识别至关重要的胞外结构域分辨率为 2.7 埃。
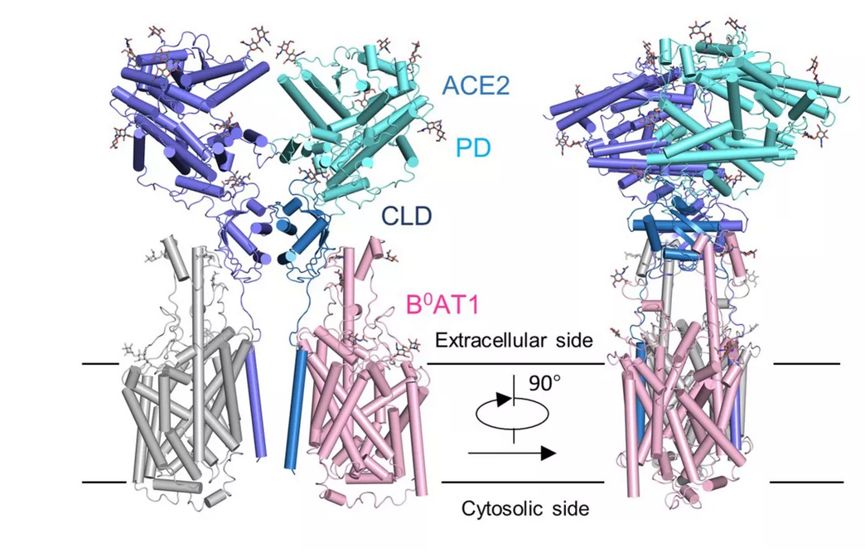
ACE2-B0AT1 复合物结构图
作为 ACE2- b0at1 异二聚体的二聚体组装的复合物,由于 ACE2 的肽酶结构域的转移而呈现开放和封闭的构象。通过分析 ACE2 的全长蛋白结构,周强实验室发现 ACE2 以二聚体形式存在,同时具有开放和关闭两种构象变化,但两种构象均含有与冠状病毒的相互识别界面。作为 ACE2- b0at1 异二聚体的二聚体组装的复合物,由于 ACE2 的肽酶结构域的转移而呈现开放和封闭的构象。
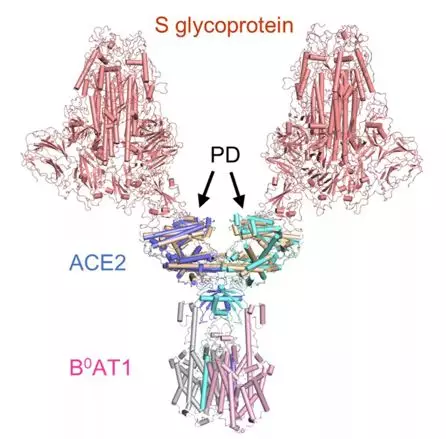
ACE2-B0AT1 复合物和之前解析复合物(SARS-CoV 的 S 蛋白与 ACE2 的 PD 结构域的复合物)的比较,
两种复合物通过 PD 结构域锚定在一起
该团队发表的文献中表示,这一结构揭示了全长 ACE2 和 B0AT1 之间的异质二聚体的组装的高分辨率结构。而建模分析表明,同时结合两个 S 蛋白三聚体的冠状病毒到一个 ACE2 二聚体。B0AT1 不参与同源二聚,而在颈部区域之间的接触。
而由于 ACE2 是广泛存在的,因此,即使在没有 B0AT1 的情况下,ACE2 也可能以同质二聚体的形式存在。该分析为 SARS-CoV 或 2019-nCoV 病毒感染的分子基础提供了直接线索。
同时,本研究的结构为阐明 2019-nCoV 感染的机制提供了一个重要的框架,并可能促进潜在疗法的发展。这一研究发现为进一步解析全长 ACE2 和新冠病毒的 S 蛋白复合物的三维结构奠定了基础。而这个工作本身为理解新冠病毒侵染细胞提供了很多有趣的线索。
文献同样提及,由于开始这项工作是因为团队对 COVID-19 的密切关注,所以结构分析的重点主要集中在 ACE2 上。但事实上,B0AT1 作为一种重要的营养物质输入体,表现出许多不同于其他 leutfold 转运体的有趣的结构特征。团队的下一个目标是在更多的构象中对 B0AT1 进行结构测定,并在单独的研究中对 B0AT1 进行结构分析。
同时,ACE2 的结构解析向进一步的科研探索提供了重要线索,比如 ACE2 的二聚体与新冠病毒 S 蛋白的三聚体是否可以发生更高层级的交联,从而促进病毒与宿主细胞膜的融合或者内吞?之前有研究表明 ACE2 的胞外区如果被切割,将会更有效地促进冠状病毒的侵染,但是 ACE2 与 B0AT1 的复合物结构显示 B0AT1 的存在有可能阻碍蛋白酶靠近这个切割位点,这是否解释了为什么病毒侵染症状主要发生在没有 B0AT1 的肺部?
这一系列通过结构研究揭示的问题有待未来多学科探索。
参考文献:
Zhou, Q., Yan, R., Zhang, Y., Li, Y., &Xia, L. (2020). Structure of dimeric full-length human ACE2 in complex with B 0AT1 [Preprint]. Biochemistry. https://doi.org/10.1101/2020.02.17.951848
cnBeta. (n.d.). 新冠病毒 S 蛋白与细胞 ACE2 亲和力是 SARS 的 10 到 20 倍—科学探索. cnBeta.COM. Retrieved February 19, 2020, from http://www.cnbeta.com/articles/science/944407.htm
MedSci. (n.d.). 综述:ACE2 的主要功能以及在新型冠状病毒中作用. Retrieved February 19, 2020, from https://www.medsci.cn/article/show_article.do?id=507018e2810f
https://www.westlake.edu.cn/info/1017/4353.htm
