

扫码打开虎嗅APP
“我们仍然不能解释为什么细胞会围在一起变成一只眼睛。也正是这点,让我对生命只有敬畏。”本文来自微信公众号:神经现实(ID:neureality),作者:COSTANDI,翻译:Nevaeh
神户市列车线路是城市交通系统的一个重要成就。它自1981年开始投入使用,是日本首个全自动无人驾驶列车。始发于三宫站,列车沿着看起来摇摇欲坠的高架轨道平稳前进。轨道下方就是奔流不息的城市街道,它一路穿过海湾,最终到达港湾人工岛。
这个岛和神户许多地方一样,在1995年的阪神淡路大地震中被夷为平地。那场地震里,5000余人死亡,超过10万栋建筑遭到破坏,这座岛是在后来才逐渐重建起来。随着列车向前驶去,摩天大楼逐渐进入视野。在城市四周可以看见赫然耸立的六甲山脉,还有从发电厂、炼钢厂和造船厂等许多细长烟囱里升起的滚滚黑烟。
如今,人工岛上不仅有神户港,还包含了酒店、医疗中心、大学、一个大型会议中心和宜家商店。此外,那里还有由政府出资的三个日本理化学研究所(RIKEN)研究机构:计算科学研究中心(到2011年为止,那里拥有着全球最快的超级计算机)、生命科学技术中心和发育与再生科学综合研究中心(CDB)。
在其中一间实验室的入口,贴着一张已经褪色的海报,被很窄的塑料边框包住,海报上方是星舰企业号的机组成员们,年轻的柯克舰长骄傲地坐在舰长椅上。下方则是广为人知的《星际迷航》台词:勇踏前人未索之境。
而在门的另一边,器官发育与神经发生实验室的科学家们则在试图解决多年来一直被科幻小说当作灵感的问题。这是一个十分前沿的新兴研究领域:用干细胞培育组织和器官,最终重建躯体。他们希望这可以为一系列衰老性疾病提供新一代治疗手段,并揭露大脑发育过程中的秘密。
眺望未知新大陆
在受精后不久的胚胎里,有着一团完全相同且未特化的细胞:它们被称作多能干细胞。它们既能一直保持在这种未特化状态,也可以随时分裂出子细胞,分化形成人体内任一类型的细胞。虽然研究者们从胚胎干细胞中,看到了医学治疗手段向前发展的希望;但是,由于这些细胞只能从人类胚胎里提取,使用这些细胞是否符合伦理,相关的质疑和讨论从未停止。
随后,在2007年,京都大学的山中伸弥小组发现,成年小鼠的结缔组织细胞能恢复到多能的干细胞样状态,再编程后可以转化成其他类型的细胞。其他研究者进一步发现,人体中几乎任意细胞都可以经过类似的再编程,分化为其他类型细胞。
2008年,美国研究者从一名82岁的肌萎缩性脊髓侧索硬化症(ALS,一种运动神经元病)女性患者身上取得了皮肤细胞。细胞被放入培养皿后,对其进行再编程,分化成为运动神经元细胞,也就是被ALS损害的那群细胞。2010年,斯坦福大学的研究者发现,大鼠结缔组织细胞可以绕过多能状态,直接再编程形成神经元。
这些进展为人类胚胎干细胞的获得,提供了一个全新的、争议更少的方式。不管是研究疾病的分子学和细胞学机制,还是测试新研发药物的作用,研究者都可以自行在实验室里培养出干细胞,对它们进行再编程,生成研究所需的任意细胞。这也为再生医学的一个里程碑——首次成功移植完全由人造组织构成的器官——奠定了基础。
首位移植受者是安德马里亚姆·泰克莱森伯特·贝耶恩(Andemariam Teklesenbet Beyene),一名36岁的厄立特里亚人,在冰岛大学攻读地球物理学的硕士学位。在冰岛学习期间,贝耶恩被诊断出来患有晚期癌症,一个高尔夫球大小的肿瘤几乎堵住了他的气管。一开始,他拒绝接受这种开创性疗法,但在和冰岛的医生及家人商讨后,最终还是同意接受新型治疗。
这一新疗法需要分散在全球各地的三个团队共同协作完成。首先,他们对贝耶恩的气管进行CT三维成像,并将数据传送至伦敦大学学院。扫描结果被用来建了一个Y状玻璃模型,外面用纳米复合多聚体材料形成一个多孔的支架。这个支架随后被送到美国哈佛生物科学公司(Harvard Bioscience),他们将这个支架“种”在从贝耶恩体内提取出的干细胞中,然后在量身设计的生物反应器里孵育了几天;这一步骤能使细胞浸透到支架的小孔里,并分化形成结缔组织。最终,支架被送回斯德哥尔摩的卡罗林斯卡医学院。在那里,医护人员进行了一场长达12小时的移植手术。
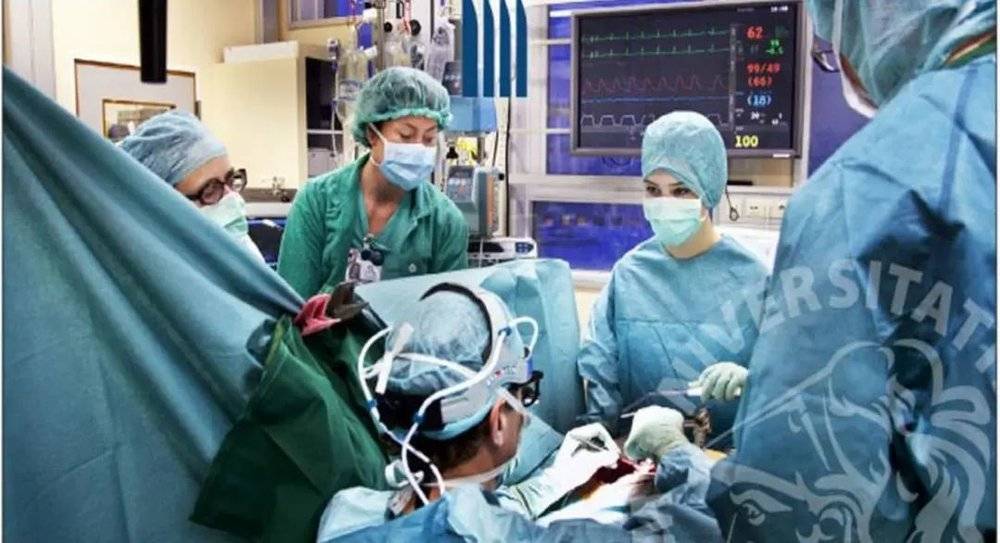
医护人员在卡罗林斯卡医学院进行了长达12小时的移植手术。图片来源:karolinska.se
保罗·马基亚里尼(Paolo Macchiarini)是卡罗林斯卡医学院的一名外科医生,他和同事们在2011年6月成功移植了首个人造气管。贝耶恩在手术后的数周内一直很虚弱,卧床不起。但最后他完全康复,并且八个月后顺利毕业。
这并非首例气管移植。但是,以前移植的气管都是从人体供者获取,从中剥离出软骨结构后、重新注入受者的干细胞。寻找合适供者常常需要数月的时间,而人工支架的使用则大大缩短了这段时间。这也拯救了贝耶恩的性命(人工气管还同时克服了其他障碍:由于贝耶恩的新气管完全由人工合成,被他的身体排斥的几率更小,所以他不需要像其他移植病人一样服用很强的免疫抑制药物,来防止排异发生)。
全球有上万人在等待器官移植,但并没有那么多器官足够所有人使用——2013年,英国的肾脏移植等待名单上有超过5600名患者,但最终只有3000多人得到了合适的肾源。全球供者短缺也变相刺激了牟利黑市的发展:从活体供者身上摘除的肾脏售价可以超过3万美元,而这些售价很快将会超过死亡供者所提供的。

medpagetoday.com
“我们的最终目标是解决移植供体器官短缺的问题,并且提出疾病治疗的新方法,”安东尼·阿塔拉(Anthony Atala)说,他是美国北卡罗来纳州维克森林再生医学研究所的主任,“我认为这一领域将会不断发展,治疗手段也会随之进步,能治疗更多疾病。”
借助支架,阿塔拉和他的同事们已经用患者自己的细胞培育出了膀胱、尿道,以及最近刚研究成功的阴道。移植结果显示这些人造器官在移植数年后仍然安全有效。“我们正在进行一项临床试验,以评估用肌肉祖细胞治疗女性患者尿失禁的安全性,”阿塔拉说,“另外,我们还有很多研究结果还未到达临床试验的阶段。比如将皮肤细胞打印在烧伤部位上,以及针对肾脏疾病、囊性纤维病和血友病的细胞疗法。”
而在神户,器官发育与神经发生实验室正用另一种无需支架的方法来培育组织和器官。值得注意的是,他们已经发现胚胎干细胞可以自我排列。只要有合适的诱导条件,这些干细胞就能形成非常复杂的三维结构。通过一种特别研发的技术,这个团队已经诱导胚胎干细胞形成了部分垂体,甚至还有一小丁点大脑。而他们目前最主要的研究成果是,培育出有感光细胞和视网膜组织的部分胚眼。正是基于这项成果,研究员们希望发展出以干细胞为基础的全新疗法,来治疗多种致盲性疾病。
“我们并不确定接下来的研究方向,” 笹井芳树告诉我,当时他正担任着实验室主任和CDB副主任的职务,“我们确实站在最远的边界上,面对着一个未知的世界。”
注意大脑发育的细节
19世纪20年代早期,很多试验让我们得知了大脑发育早期的重要细节。
一个有机体在发育伊始,胚胎要首先经历一个叫做原肠胚形成的阶段。这个形成期会彻底改变胚胎的发育格局:先经过一系列的大规模细胞迁移,把原本由相同干细胞组成的中空球样胚胎,变成一个有着三层结构的实体形状,而这三层结构最终将形成人体的各个部位。刚开始,神经系统是最外层结构——也被称作外胚层——上的一段片状组织。这个薄片不断增厚、变大,然后进入了神经胚形成期,薄片内卷变成一个中空管,并从胚胎表面脱离,转而内陷于胚胎中。这个中空管最后会形成大脑和脊髓,而外胚层余下的部分将变成皮肤。
德国胚胎学家汉斯·施佩曼(Hans Spemann)从20世纪初开始研究胚胎发育。施佩曼喜欢亲手制作显微手术器材,也鼓励学生们这样做。他用从女儿头上拔下的一股头发,制成了一个细环。借助这个细环,他小心翼翼地把两栖动物的胚胎一分为二,发现只有包含了一小块组织的那一半胚胎才能继续发育成蝌蚪。而这一小块组织将会变成被称为施佩曼组织者(Spemann’s organiser)的结构,原肠胚形成期间所有的大规模迁移以及人类身体的形成都始于此处。
汉斯·施佩曼(Hans Spemann)图片来源:nobelprize.org
施佩曼还将蝾螈或者蜥蜴胚胎的组织移植到另外一个物种的胚胎里。由于移植的组织细胞在显微镜下不同于宿主细胞,他因此能够追踪到供体组织最终去了哪里。有一次,施佩曼把一个胚胎的组织者移植到了另外一个胚胎之后,发现它诱导了第二体轴的出现,甚至还有一个完整的第二神经系统结构。
当希尔德·普洛斯尔特(Hilde Proescholdt)作为博士生来到施佩曼实验室时,施佩曼让她赶紧深入研究这一问题。她照做了。通过用两种皮肤颜色不同的蝾螈再次试验,她确认了施佩曼组织者在移植后,可以诱发第二体轴的形成和神经系统——直接创造了同体双胞胎蝌蚪。值得注意的是,组成第二神经系统的细胞来源于受体组织,而不是供体。因此,施佩曼组织者用了某种方法,让附近的受体细胞形成了神经组织。
开始着手写这篇论文之后,普洛斯尔特嫁给了施佩曼实验室另一位成员,奥托·曼戈尔德(Otto Mangold)。没过多久,他们柏林家中的厨房煤气炉发生了爆炸,她死于严重烧伤。在她去世后,她的论文才发表出来。当时,胚胎学家们猜测施佩曼组织者分泌了一种可以诱导神经系统形成的蛋白。于是,他们决定着手识别这一蛋白。
研究持续了将近70年。在90年代早期,两组研究者识别出了施佩曼组织者分泌的两个蛋白,卵泡抑制蛋白(Follistatin)和头蛋白(Noggin)——后者的名字来源于英国俚语中的“头”。令人惊讶的是,这些蛋白并不诱导活动,相反,它们以“解除抑制”的方式进行间接操作:它们会拮抗另外一群蛋白,这群蛋白通常会抑制外胚层细胞向不成熟神经元的分化,反而诱导它们变成皮肤细胞。也就是说,这些外胚层细胞注定要变成神经元,除非卵泡抑制蛋白和头蛋白让它们分化成其他细胞。

笹井芳树。图片来源:Wikipedia
“那段时间真是令人激动,”安德鲁·蓝斯顿(Andrew Lumsden)回忆道,他是伦敦英国医学研究理事会(MRC)发育神经生物学中心的创办者和上一届主任,“发育过程是通过阻止某些活动,而非增强这些活动来完成。这个想法非常创新,也给了所有人一个提醒。因为自从施佩曼和曼戈尔德的结果发表之后,所有人都在寻找神经系统的诱发物。”
那段时间,笹井芳树正在加利福尼亚大学爱德华·德·罗伯蒂(Edward De Robertis)实验室做博后工作。他在1986年于京都大学获得医学学位,随后成为一名内科住院医师。在此期间,他逐渐对大脑发育产生了兴趣。到达洛杉矶几个月后,笹井芳树分离出了编码脊索蛋白(chordin)的基因,它所编码的这一蛋白也能诱导神经组织的发生。笹井后来证明,脊索蛋白的作用机制是阻断对诱导干细胞向皮肤细胞分化的信号。
从那时起,全球各地的研究团队识别出了大脑发育过程中的许多分子和机制。现在我们知道,许多基因都参与了神经系统的分化,确保在发展过程中能在正确的地方生成正确的神经细胞;除此之外,我们还知道有许多基因都在引导不成熟神经元(和它们随后伸展出的纤维分支)转移到合适的终点。
这套知识构成了笹井的研究基础。原本只是对大脑发育过程的探索,却在不经意间发展出了在实验室里培育复杂组织的可能有效的方法。反过来,这也可能帮助我们揭开有关形态发生(morphogenesis)的某些谜底。在这个过程里,一片扁平的组织最终能变成一个有着高度复杂皮层的完整大脑。
细胞漂浮簇集
我在2014年1月下旬来到了CDB,笹井当时十分抢手:他的同事们刚刚发表了一项有关干细胞的重大发现,笹井也参与了其中一小部分。几家日本电视台的采访团队正站在CDB门口,希望能采访到笹井芳树。
《星际迷航》海报的楼上是一间会议室,里面有个大会议桌和一块竖立的白板。书籍和科技期刊占据了整整两面墙。房间的一扇门背后就是笹井的办公室,我看着两名行政助理匆忙地进进出出。另一扇门后面是实验室的主要区域,里面既有堆着试剂瓶的架子,也有塞满了离心机、一次性洗液头盒子、乳胶手套的实验台,本来很大的实验室被它们分隔成了许多小空间。我坐在会议桌后等待着笹井。
走廊两边还有些其他房间,拖鞋在门口整齐摆放成好几排。这些房间里面放置着更加专业的实验器材。其中一个是配备了微观悬臂的原子力显微镜,笹井和同事们用它来测量参与形态发生的微小机械力。另一个房间里放着一台转盘式孵育共聚焦显微镜,小组成员可以用它拍摄他们的人造组织弯曲和伸展时的状态。*
*译者注:共聚焦显微镜利用逐点照明和空间针孔调制,去除样品非焦点平面的散射光,相比于传统显微镜可以提高光学分辨率和视觉对比度;转盘装置则能实现快速图像采集,拍摄出样品的实时状态。
比起皮肤或者结缔组织,这些复杂组织培养起来更具有挑战性。笹井和同事们发明了一种新的方法,让胚胎干细胞在3D状态下生长并维持——也就是让它们悬浮在培养基中接受滋养,而不是平整地放在培养皿表面。他们发现,以这种方式生长的胚胎干细胞可以自发地排列,形成一些复杂组织,比如眼球、腺体和脑组织。
笹井回到京都成立了自己的实验室之后,在2000年想出了这个方法。随着对大脑发育的兴趣不断增长,他和同事发明了一套培养细胞的方法,以将小鼠胚胎干细胞转化成不同种类的神经元。一开始,他们尝试着在培养皿里的“饲养”细胞(feeder cells)一旁培育干细胞。饲养细胞可以分泌干细胞成熟所需的信号,让它们脱离胚胎状态并分化为成熟神经元。
然而,这个方法不太有效,只有一小部分干细胞能成为成熟神经元。因此,笹井怀疑发育和干细胞培养环境有关。从1887年开始,培养皿在全球被广泛应用于细菌和其他细胞的生长,但是它又平又浅,而真正的生命都发生在立体空间中。笹井推测,培养皿限制了干细胞,干扰了发育机制不让其生长。随后,他开始着手于设计一个“漂浮的”细胞培养系统。
一开始,他在96孔板里培养小鼠胚胎干细胞。这个孔板一般用来储存少量液体和组织样品。笹井团队起初很难让细胞成团。“我们和一家公司进行合作,通过优化孔板结构,来让细胞成团,”他谦虚地告诉我——并未提及在完善这一培养方法过程中所遇到的极大挑战。当初其他研究者绞尽脑汁也没能成功。笹井团队还放弃了标准的细胞培养基。一般来说,这些培养基里包含了好几种生长因子和信号分子(包括一些不明分子)。他们选择转而使用自己调制出的混合物。
团队用了五年时间来研发技术。到2005年,这项技术终于成熟了。在他们的特定培养基里,3000个干细胞可以成功簇集在一起,形成一个叫做胚状体样结合(embryoid body-like aggregates)的球形结构。由于这些细胞之间紧密地结合在一起,它们几乎可以像在真正的胚胎里一样互相交流。更重要的是,外胚层在默认情况下会形成神经组织,所以这些胚状体迅速富集了一堆不成熟神经元。用笹井技术培养出的胚胎干细胞,比起普通培养基,能够更高效地产生成熟神经元。团队还证明这种技术也能应用于诱导胚胎干细胞分化成不同种类的神经元,包括产生神经递质多巴胺(多巴胺在帕金森病里明显退化)的中脑神经元和小脑的浦肯野细胞(Purkinje cells )(在一些运动性疾病中会彻底消失)。
“在子宫里,胚胎是立体发育的,” 笹井解释道,“所以使用我们的培养技术,胚胎干细胞可以更顺利地模仿自然发育。”不仅摆脱了普通培养皿的限制,培养基里还有合适的信号分子组合,胚状体样结合终于开始发育。
有了他们最初研究成果的铺垫,笹井的团队还发现,以这种方式培养的胚胎干细胞可以自发排列组成层状结构。这种结构类似于15天大小的小鼠大脑皮层。大脑皮层由六个不同层面组成,每一层有着以特定方式组合的特定类型细胞。在早期发育的阶段,未成熟神经元一波又一波地在胚脑里移行,于是由内往外形成了一个又一个的层面。3D培养基里的胚胎干细胞可以自己模仿这些移动,形成了在正确位置有正确细胞的层状结构。在这个迄今为止其他人都失败了的领域,他们取得了成功:在实验室里培育出一个大脑,或者至少是一部分。
笹井到达采访时,他看起来冷静、寡言,显然没有因为走廊外面喧闹的媒体而慌乱。他坐在我旁边的桌子前,助手为我们端来了绿茶。我问起那张《星际迷航》海报。他说,他并不是什么超级粉丝,只是认为那张海报很适合,因为他也不知道这些人造器官的发展方向。
向大规模培育进发
脑组织是这个团队所创造出复杂度最低的结构。对培养环境稍做改变之后,他们开始仿造其他复杂的器官。
笹井把外胚层细胞放在悬浮培养液中生长数日后,细胞开始自发改变形态。一开始它们向外突出,然后稍微内陷,形成一个类似胚眼的杯样结构,里面含有未成熟的视网膜细胞。当这个组织被切下来、单独培养两周以后,它发育成了一个有着六层结构的视网膜,类似于一个8天大小的小鼠眼睛。
2011年笹井团队报道,他们已经利用细胞培养系统成功培育出了部分脑垂体。脑垂体常被称作“主腺体”(the master gland),因为它控制着激素的生成,而这些激素会控制其他腺体。两个不同部位的胚胎组织互相作用,形成了笹井团队的人造垂体;它们的同时存在导致了一部分外胚层自我折叠,并从主体分离,形成一个小囊袋。囊袋里的细胞继续变化,产生了成熟脑垂体含有的六种不同激素分泌类型的神经元。培养这个垂体要花上约三周的时间,即便培养结束,它也不是一个完整腺体。但是笹井团队把这个部分人造腺体,移植到手术摘除垂体的小鼠大脑中,小鼠产生激素的功能已经可以完全恢复。
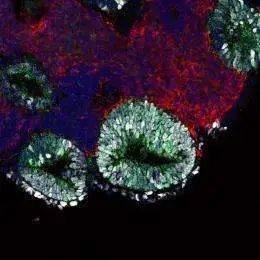
2011年笹井团队报道,他们已经利用细胞培养系统成功培育出了部分脑垂体。图为第13天培养时,通过显微镜拍下的细胞聚集形成胚胎垂体腺的照片。图片来源:riken.jp
笹井团队培育组织的过程看起来简单,实则不然。从小鼠体内获取胚胎干细胞后,直接放入改良96孔板中。每个孔洞有0.3毫升左右的特定类型培养基,包括脑组织、垂体组织和胚眼三种。一旦这些孔板被转移到孵化器中,培育就开始了。
为了将人造组织更好地应用于治疗,团队决定向大规模培育方向发展。“其中一项直接应用就是针对生长激素缺乏患者的细胞移植疗法,” 笹井说道。与此类似的,还有他们正在培育的人造视网膜组织。这种组织也许在未来能治疗黄斑退化和视网膜色素变性这两种致盲性疾病,“我们正在把人造视网膜组织移植到失明动物里,以评估这些组织的功能。”
伦敦大学学院的眼科学家罗宾·阿里(Robin Ali)和同事已经尝试,把年轻小鼠未成熟的视网膜细胞,移植到部分失明的成年动物体内。最近他们发现这些成年动物可以恢复部分视觉功能。他们正在与高桥雅代一起合作,也使用笹井的3D培养法培育视网膜组织。高桥雅代是笹井在理化学研究所CDB的另外一名同事。她同时也计划把视网膜移植到猴子体内。2013年,她开始了一项预实验。为了评估人工视网膜的有效性,她将人诱导多能干细胞产生的视网膜细胞移植到黄斑变性的患者体内。目前,她已开始招募参与实验的人。*
*译者注:该试验结果已在2019年发表,详情见:https://www.sciencedirect.com/science/article/pii/S2468653019300909?via%3Dihub
“再生医学”能创造新生吗
“再生医学”这个词最早出现在1992年的一篇文章中。这篇文章的作者是医疗保健系统未来学派的利兰·恺撒(Leland Kaiser),而再生医学作为其中一段文字的副标题,这段描述了一个“医学的新分支……尝试改变慢性疾病的方向和……重新生长出那些疲劳失效的器官系统”。通过笹井和其他人的研究,这个分支正逐渐冒出萌芽。
然而,并不是所有人都被说服了。“关于‘培育大脑’有很多夸大之词,”蓝斯顿说,“你不可能培育一个大脑。你可以培育出一些有神经元的组织块,但它们的体积不可能比一颗豆子更大了。”
“问题就在于体积,”他继续说道,“你不可能在没有任何血供的情况下,长出一大团组织。一个细胞必须离最近的毛细血管五个细胞直径以内,因为这样它才能存活下去。”正因如此,人造组织的体积绝对不超过几个毫米。想使用笹井的3D培养法长出比胚眼和部分脑垂体更大的组织,这似乎不太可能。
而还有一些人则在质疑将人造器官移植到患者体内这一策略。“虽然人造大脑和眼睛看起来很棒,但我并不认为这是真正的治疗,”克里斯·梅森(Chris Mason)是伦敦大学学院的一名再生医学生物工艺教授,他说道,“为什么要等到患者完全失明了才去做这种大规模治疗呢?我们应该尽早干预,并尽可能减小治疗规模。如果房子起火,你就该立刻扑灭。而不是等到整个房子烧成废墟之后,再重新盖一个房子。”
根据梅森的看法,再生医学真正的潜力在于培养来自患者的细胞。“我认为,最大的价值是我们可以更好地理解疾病,”他说,“你可以从帕金森氏病或者其他运动神经元疾病的患者体内,提取出诱导多能干细胞,再分化出神经元。而我们将有机会从这些神经元中更好地理解疾病进程,从而推动或是逆转进程、或是阻止疾病发生的新药研发。”
但当我与笹井会面时,他却深信他的方法最终可以引领我们发现——他毫不谦虚地称之为——“下下一代”的治疗手段。他希望特定类型的人造神经元可以帮助我们提出新型疗法。无论是像阿兹海默症、帕金森氏病和运动神经元疾病这些神经元退化性疾病,还是休克或其他脑损伤,这种新疗法都可以把它们导致死亡的细胞全部替换为新细胞。
自我排列的生命谜题
2014年8月5日,笹井芳树被发现死于实验室附近。他的死因明显是自杀:这场悲剧与1月的一项干细胞重大发现相关,该论文发表在《自然》之后,对这项发现的质疑不绝于耳,最终论文被撤稿(即小保方晴子事件)。野依良治是日本理化学研究所理事长,他在关于笹井死亡的声明里说,“科学界失去了一位有献身精神并极具天分的研究者,这些年里他所做的开创性研究,值得我们所有人发自内心的尊敬。”在写下本文的时候,一个独立委员会已建议解散CDB。
虽然后来笹井被澄清与这一学术不端事件无关,但是,由于他没有正确地监督指导工作人员,他仍然受到了很多的批评。他在2000年协助建立了CDB,他的团队所取得的成果也让CDB成为一所世界级的研究机构。据说,这一学术事故吞噬了他和他的机构,因此使他感觉“十分羞愧”。
2014年1月那个下雨的早上,笹井和我一起坐在会议室里,他知道他的研究面临着许多挑战,但他对研究的潜能却是坚定又乐观。“我们正在尝试从人胚胎干细胞里培养出神经元,”他说,“但如何更高效地转换仍然存在技术上的问题。我们在试着通过视觉成像来监控移植细胞的活动。”他还预测,五年内人造视网膜可以在人体上测试,而体外培养移植器官将在接下来的十年里逐渐常态化。

RIKEN官网发布的笹井芳树博士讣告。图片来源:riken.jp
但他也说到,他仍然无法解释细胞是怎样自我排列形成如此复杂的结构。“看到那些不需要任何外部推力或影响就出现了的精密结构。这真是令人吃惊。”他告诉我,并把这个比作政治——一种细胞民主。在生长过程中,细胞既影响其他细胞,也被其他细胞所影响;同时不断推动拉扯,抢占空间,争夺生长所需的有限资源。
“自我排列意味着,所有这些过程都是民主调控,”他说,“整个过程完全是自发的。细胞们知道怎么制作一个视杯或者层状皮质。不是我告诉它们怎么做——而是它们相互交流,一起做出决定。”
笹井相信,自我排列只出现在一定规模的群体中。“这种情况仅在大约1000-100000个细胞数量的群体中发生,”他说,“在这个层次,细胞可以直接民主化,不需要被特别长官或者总统指挥。在数百人的小村庄里,人们可以聚在一起,讨论该怎么做,但是一个国家如果没有政府,则会全部乱套。”
“自我排列太神秘了,”他继续说,拘谨的举止已经让步于孩童般的好奇心。“我们仍然不能解释为什么细胞会围在一起变成一只眼睛。一定有更多我们尚未知晓的原理。也正是这点,让我对生命只有敬畏。”
本文来自微信公众号:神经现实(ID:neureality),作者:COSTANDI,翻译:Nevaeh,原文链接:https://mosaicscience.com/story/man-who-grew-eyes/
