
扫码打开虎嗅APP

本文来自微信公众号:返朴(ID:fanpu2019),作者:Gene,题图来自:视觉中国
划重点:
1. 抗体依赖增强(ADE)效应主要发生在具有Fc受体的免疫细胞。许多病毒(包括冠状病毒)都发现了ADE效应的证据,主要表现是增强病毒感染能力。
2. 体外实验发现ADE现象,不代表一定会影响临床结果。
3. 提高抗体质量是减少疫苗ADE风险的关键。
近来,各国的新冠疫苗研发纷纷进入三期临床阶段,新冠病毒(SARS-CoV-2) 疫苗的安全性问题再次进入公众视野。不少文章都提到,ADE效应可能是新冠疫苗的潜在风险。
什么是ADE效应?ADE全称Antibody-dependent enhancement,意为抗体依赖性增强,比较通俗的解释是:病毒在感染细胞时,由于某些原因,体内已有的相关抗体会增强病毒的感染能力。换言之,经自然免疫或疫苗接种后,再次接触相关病毒时,体内产生的抗体可能会增强其感染能力,最终导致病情加重。
那么,ADE在科学上是如何解释的?新冠病毒是否也存在ADE效应?我们应该怎样避免?本文将深入介绍病毒的ADE效应,希望帮助大家正确理解科学现象和科学结论。
抗体依赖性增强效应的发现
抗体(antibody)最早是由德国科学家贝林(Emil Adolf Von Behring)和日本科学家北里柴三郎(Kitasato Shibasaburo)共同发现的。他们发现,将感染破伤风杆菌的兔子血清注入小鼠体内,可以使小鼠免受破伤风杆菌以及破伤风毒素的侵害[1]。随后,贝林又给豚鼠注射了灭活的白喉杆菌和白喉毒素,发现豚鼠的血清也具有了抗白喉杆菌和白喉毒素的保护性[2]。因此,贝林认为免疫后的动物血清中会产生一种名为“抗毒素(antitoxin)”的保护性物质,可以与外来抗原(antigen)反应而起作用。
“抗毒素”也就是后来所说的抗体,1891年,德国科学家埃尔利希(Paul Ehrlich)首次使用了“抗体”(antikörper)一词[3]。后来科学家又发现抗体主要分为五种亚型:IgA、IgD、IgE、IgG和IgM。
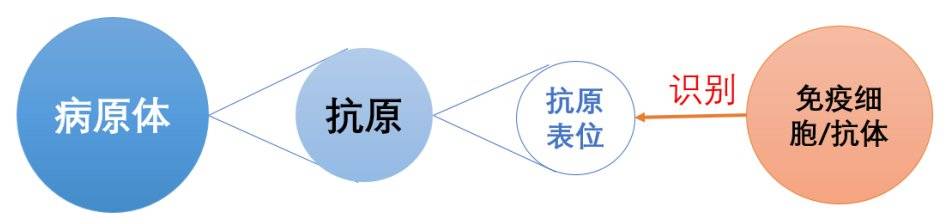
抗原(antigen)是指病原体上能够被免疫细胞特异性识别的分子。每个抗原可以有一个或多个抗原表位。抗原表位更加细致,它是抗原分子中决定抗原特异性的化学基团。免疫细胞(或抗体)主要通过识别抗原表位来与抗原相互作用,进而引发免疫反应。(见下图)
1964年,澳大利亚科学家Royle Hawkes在一次实验中意外地发现,在高度稀释的鸡抗体血清的环境中,黄病毒科的多种病毒对鸡胚成纤维细胞的感染性增强[4]。这一发现与“血清具有保护作用”的认识相矛盾,Hawkes对自己的发现产生了怀疑。
3年后,Hawkes终于证实,血清确实有可能增强病毒的感染性,并进一步发现,这一现象和血清中的IgG抗体有关[5]。抗体本是机体抵抗病毒入侵的盾牌,但病毒却可以“以子之盾,化己之矛”,依靠抗体的帮助入侵细胞。这是人类首次认识到病毒的抗体依赖性增强效应,但当时Hawkes并没能解释这一现象的具体机制。
现在,广义的ADE认为:
一些不理想的抗体可以增强病毒感染能力,甚至协助病毒进入原先无法进入的细胞,进而导致病毒大量复制或免疫细胞应答异常,最终使感染者病情加重,导致组织病理损伤。
直到 1977年,登革热领域的先驱、著名病毒学家Scott Halstead才将登革热病毒(dengue virus,DENV)在临床上引起的重症登革热和ADE联系起来——部分感染者康复之后获得了对登革热病毒的免疫力,然而一段时间后,当这些患者第二次感染登革热病毒时,病情反而比第一次更严重。
登革热病毒分为不同的血清型(即病毒的亚种),实验发现,对I型、III型和IV型具有免疫力的猴子在接受II型病毒感染后,体内的登革热病毒不但没有被清除,病毒水平反而还明显高于其他猴子。Halstead进一步发现,登革热病毒在具有免疫力的猴子或人的外周血白细胞中复制得更快。基于种种证据,Halstead得出结论,ADE和白细胞有关:在有抗体的条件下,病毒可以在白细胞中大量复制[6-8]。
为什么发生在白细胞?
这要从病毒感染细胞的步骤说起。病毒在进入人体后,首先通过自身的膜蛋白与人体细胞表面受体结合,之后通过膜融合或细胞内吞作用进入细胞,随后释放遗传物质,进行复制装配,最后释放病毒“子代”,继续感染其他细胞。
病毒入侵白细胞的过程亦不例外。Halstead解释说,ADE是由白细胞表面的Fc受体(FcR)介导发生的。在抗体的Fab段识别和结合病毒后,抗体的Fc段与白细胞(包括单核巨噬细胞、B细胞、中性粒细胞等)表面的Fc受体相互作用,使病毒粘附于白细胞表面,促进了白细胞对病毒的内吞作用,相当于“引狼入室”,增强了病毒的感染能力。这也是目前ADE发生的最主要机制。
什么是抗体的Fab段和Fc段?一张图带你认识——
图1. 抗体即免疫球蛋白(immunoglobulin, Ig)分子,基本结构呈“Y”字形。Y字形的两臂是识别外来抗原的关键所在,所以也称为抗原结合片段(fragment antigen binding),即Fab 段;Y字形的根部称为可结晶片段(fragment crystallizable),即Fc段,主要负责调节免疫细胞活动。另外,Fc段也与ADE有关。作者作图
随后,著名病毒学家、香港大学公共卫生学院前院长Malik Peiris通过更详细的实验证据阐明了这一机制[9, 10]。Peiris发现,在西尼罗病毒(WNV,属于黄病毒科)感染巨噬细胞系的过程中,阻断白细胞表面的特定Fc受体与抗体Fc段的结合,就可以阻断病毒感染的ADE效应。其他研究者在登革热病毒和黄热病毒(YFV,属于黄病毒科)的实验中也得到了同样的结论[11, 12]。黄病毒科因为ADE而一时名声大噪。
ADE机制不止一种
1983年,马来西亚病毒学家Jane Cardosa发现了黄病毒科的另一种ADE机制。实验中,在IgM抗体存在的条件下,西尼罗病毒对淋巴瘤细胞的感染性增强。然而,像过去一样,阻断细胞表面的Fc受体,却不再有用;而如果阻断抗体Fc段与细胞表面的III型补体受体(CR3)的结合,则可以停止病毒的感染性增强作用[13]。
补体(complement)是血清中一组活化后具有生物活性的蛋白质,可对特异性抗体起到补充和辅助作用,主要介导非特异性免疫和炎症反应。补体系统包括补体固有成分、补体调控成分和补体受体(CR)。
这意味着,Cardosa实验中出现的ADE效应是由细胞表面的补体受体介导的。IgM抗体的Fab段识别并结合病毒后,抗体的构象改变,暴露出Fc段的补体结合位点——本来,这是为了激活补体系统,帮助抵抗病毒,然而出招便露破绽——补体系统被激活后,病毒-抗体复合物与靶细胞上的补体受体相结合,反把病毒送进了细胞内部,进一步增强了感染。
这一途径独立于Fc受体介导的ADE,因为Fc受体只在免疫细胞中表达,而补体受体表达的细胞类型则相对较广[14],病毒加剧入侵的细胞范围也更广。
目前,Fc受体介导和补体受体介导是ADE最常见的两种机制。除了黄病毒科外,科学家们也相继在其他病毒科的多种病毒中都发现了ADE现象,其中机制亦不完全相同。
冠状病毒中的ADE效应
冠状病毒(CoV)中的ADE效应首次发现于1980年[15]。著名冠状病毒学家Niels Petersen对幼猫进行猫冠状病毒的感染实验,引发猫传染性腹膜炎(FIP)。实验中,他发现自然条件下猫传腹病毒FIPV*抗体阳性的幼猫比抗体阴性的幼猫发病时间更早,死亡也更快,也就是说对FIPV有免疫力的幼猫在被感染后,疾病反而更严重。
*注:FIPV是猫冠状病毒FCoV的一种。
一年后,研究者证实,预先注射抗FIPV血清或抗体(实验中称为被动免疫)的幼猫,在感染FIPV时,发病时间和死亡时间同样早于对照组的幼猫[16]。1990年,研究者给幼猫打FIPV疫苗(实验中称为主动免疫),在体内确认检测到抗体后,再用FIPV去感染这些幼猫,也得到了相同的结果[17]。至此,FIPV感染过程中的ADE现象终于广为人知。
又过了两年,研究者才发现了猫冠状病毒ADE效应的机制。原来,某些抗FIPV的IgG抗体可以增强FIPV对巨噬细胞的感染能力,且该过程和 Fc受体相关[18]。此后,对FIPV 的ADE效应的研究越来越多。

图2. Petersen与FIPV感染康复的小猫Tony[19]。
2005年,研究人员在实验中首次发现,针对人SARS冠状病毒(SARS-CoV)的抗体可以增强另一种SARS毒株对宿主细胞的感染[20],并且在人B细胞和巨噬细胞中,SARS病毒的ADE效应与特定类型的Fc受体(FcγRII)相关,阻断这一受体可以阻断ADE的发生[21, 22]。
值得注意的是,SARS-CoV通过ADE感染巨噬细胞的过程,并非是通过单纯大量复制病毒加剧感染(图3A),而是干扰各种细胞因子信号(图3B),导致巨噬细胞在中后期负担过重,出现活化异常,炎症因子分泌增加,最终造成急性炎症和机体病理损伤[23, 24]。
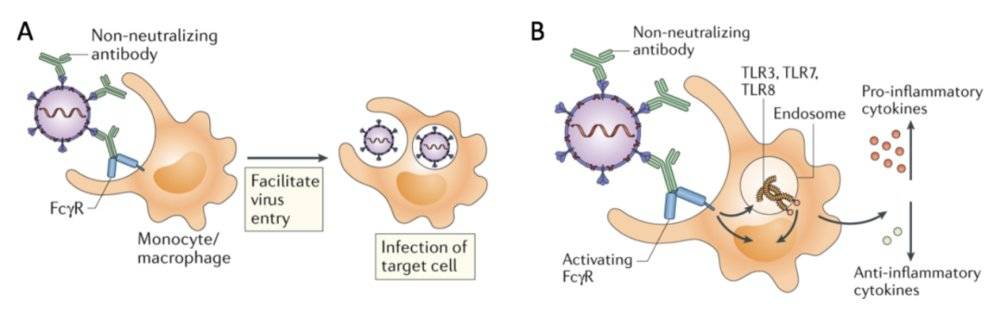
图3. 不理想的抗体导致冠状病毒感染加剧的两种方式。绿色代表抗体,黄色代表细胞,细胞表面突起的蓝色为Fc受体。改编自参考文献[25]。
另一项针对MERS冠状病毒(MERS-CoV)感染的ADE的体外研究发现,有些不理想的抗体和病毒表面的刺突蛋白结合后,可以使刺突蛋白的构象发生改变,结果,不但病毒仍然可以和相应的细胞表面受体结合,同时抗体的Fc段也可以与细胞表面的Fc受体结合,反而让病毒更容易进入细胞[26]。这说明如果初次感染时诱导的抗体不够理想,也可能直接引发ADE效应。
基于SARS和MERS冠状病毒的证据以及临床研究,已有研究者合理推测,新型冠状病毒SARS-CoV-2感染也存在ADE效应[27, 28]。最近的一项体外研究(预印本)显示,SARS-CoV-2的单克隆抗体MW05可能通过Fc段与靶细胞表面的特定受体(FcγRIIB)结合,引起ADE效应,具体结果仍需进一步验证[29]。除此之外,另一项预印本研究显示,在新冠病毒感染的重症患者中,IgG抗体可能会诱导巨噬细胞产生超炎症反应,进而损坏肺内皮细胞屏障的完整性,引发微血管血栓[30]。
什么是“不理想”的抗体?
决定抗体是否会引起ADE的因素主要包括:抗体的特异性、滴度、亲和力以及抗体的亚型[25]。
SARS疫苗包括不同种类,针对刺突蛋白(S蛋白)的疫苗和核衣壳蛋白(N蛋白)的疫苗所选择的抗原不同,诱导出的特异性抗体也不同。在小鼠实验中,给小鼠打疫苗后, 这两类疫苗诱导出的特异性抗体滴度是相似的,随后,再让这些小鼠感染SARS-CoV,发现编码N蛋白的疫苗会诱导小鼠分泌更多的促炎症因子,小鼠体内某些白细胞的肺部渗透也相对增加,肺病理学变化相对更为严重[31]。
相似地,在猴子模型中,针对SARS-CoV的刺突蛋白的不同表位的抗体,其诱导的反应也各不相同,有些可以起到很好的保护作用,有些则容易引起ADE效应[32]。
抗体滴度低也容易引起ADE效应,例如在SARS或MERS冠状病毒感染过程中,如果增加抗体滴度则可以抑制ADE,并促进中和反应的发生[26, 33]。在中和反应过程中,高亲和力的抗体还会比低亲和力的抗体保护效果更好[34]。
具有中和作用的抗体叫做中和性抗体。中和作用指的是抗体Fab段与相应的抗原表位结合,封阻其受体结合位点或致其构象改变,使抗原无法进入细胞。
抗体的亲和力,通俗来讲是指抗体同抗原结合的牢固程度。
此外,抗体的亚型不同,其Fc段调节免疫细胞的功能也各不相同:IgM能够更有效的激活补体系统,产生促炎症反应,IgG则根据细胞表面不同的Fc受体来调节免疫反应,如在SARS-CoV感染过程中,有些类型的Fc受体(FcγRIIa和FcγRIIb)可以介导ADE发生,有些(FcγRI 和FcγRIIIa)则不能[33]。进一步的,同一类型的Fc受体的不同剪接体(isoform),引发的ADE效应也不尽相同[35]。
疫苗研发如何避免ADE?
在新冠疫苗的研发过程中,减少ADE风险的关键在于提高抗体的质量,主要包括抗原表位与佐剂的选择。
抗原表位的选择尤其重要。此前SARS疫苗的开发过程中,在小鼠或猴子身上,有些疫苗一定程度上可以引发ADE效应,或引起由嗜酸性粒细胞介导的免疫病理学变化[20, 23, 36]。究其原因,可能是疫苗中起主要贡献的优势抗原表位诱导出的抗体质量(主要是滴度)不理想。
所谓佐剂,就是预先或与抗原同时注射的物质。佐剂可以有效增强机体对抗原的免疫应答,也可以改变免疫反应类型。研究显示,在老年小鼠中,铝佐剂增强的灭活SARS疫苗可以诱导出高滴度的抗体,但却是不理想的抗体亚型。此外,不适当的佐剂还会改变免疫反应类型,进而影响免疫应答过程,引起肺病理学变化[36]。
除此之外,疫苗的接种途径也会影响其作用。针对同一种SARS疫苗,分别经鼻腔途径或肌肉途径接种,再经病毒感染后,前一种途径的接种者出现的肺部病理学变化更少[37]。另外也有研究显示,利用生物手段为疫苗颗粒表面包装一层外壳,例如在登革热疫苗颗粒表面包装磷酸钙矿化外壳,可以在不影响其保护效果的同时,有效避免ADE现象的发生[38]。
从ADE的发生机制入手,也能为疫苗研发“避雷”。既然大部分ADE效应是由细胞表面Fc受体介导发生的,那么封阻细胞表面的特定Fc受体,则可以防止病毒-抗体复合物与Fc受体结合,进而阻止ADE效应[39]。
要想实现这一过程,针对Fc受体的特异性抗体,或抑制结合过程的小分子抑制剂都是不错的选择,前者可以作为免疫抑制剂使用[40,41]。例如,临床上对重症COVID-19患者使用静脉注射免疫球蛋白,可以改善患者症状[42, 43],但大范围是否安全有效还需进一步研究。
总之,通过封阻病毒-抗体复合物与Fc受体结合也是一种阻止ADE发生的手段,但是除了Fc受体外,ADE仍可以通过前述其他途径,如补体介导发生。
因此,在开发疫苗时,不但要保证诱导出高质量的中和抗体,最重要的是还要尽量选择可以诱导强细胞免疫的疫苗。实际上,机体清除病毒也依赖于细胞免疫,因为中和抗体只能对细胞外的病毒起作用,对于进入细胞内的“漏网之鱼”往往无能为力。病毒在细胞内会将其蛋白信息表达在感染的细胞表面,而杀伤性T细胞能够识别这些信息,从而发动攻击,将病毒与其感染的细胞共同杀灭。
同样重要的是,初次免疫(即疫苗接种)除了诱导出抗体外,还会产生记忆细胞。疫苗诱导的细胞免疫越强,激活的杀伤性T细胞就越多,转化的记忆性T细胞就越多,这样一来,在下次病毒感染时,免疫细胞行使功能的速度也就越快,从而有效地减少ADE的发生。因此,疫苗的种类选择也至关重要。
结语
新冠疫苗研发至今,已公布的多项动物结果和临床试验结果均未出现明确的ADE证据。但是基于SARS疫苗和MERS疫苗的经验,笔者认为,在极个别新冠病毒单克隆抗体中发现ADE效应的确证,大概率只是时间问题。
虽然前文写到,已有研究初步表明新冠病毒的某些单克隆抗体在体外可能存在ADE效应,但目前证据仍不充分。更需要注意的是,体外实验与体内情况往往有较大差距,离临床表现更是相去甚远。机体经抗原免疫后,会出现针对多个表位的多克隆抗体反应,即便单个抗体具有ADE效应,也难以影响血清的中和性。
单克隆抗体是由单一B细胞克隆产生的、仅针对某一特定抗原表位的抗体。相应的,多克隆抗体是针对多种抗原表位的不同抗体。
另外,除了疫苗以外,开发单克隆抗体、制备抗体药物也是一种不错的选择。单克隆抗体具有分子精度,易于通过基因工程学编辑,如仅使用抗体的Fab段、或使用工程学对抗体的Fc段进行改造(如引入突变),都可以显著提高安全性[44]。
目前,世界各地的科研团队正在开发的新冠疫苗已有百种,其中至少30种已进入临床试验阶段(中国有10种),最快的已经开展临床III期,其余还有多种正在动物模型上开展试验[45]。同时,单克隆抗体的开发竞赛也正如火如荼。笔者认为,ADE不会成为新冠疫苗开发过程中的障碍。
参考文献
[1] Behring E, Kitasato S. Über das Zustandekommen der Diphtherie-Immunität und der Tetanus-Immunität bei Thieren. Dtsch Med Wochenschrift 1890; 49:1113–1114.
[2] Behring E. Untersuchungen ueber das Zustandekommen der Diphtherie-Immunität bei Thieren. Dtsch Med Wochenschrift. 1890; 50:1145–1148.
[3] Lindenmann J. Origin of the terms 'antibody' and 'antigen'. Scand J Immunol. 1984 Apr;19(4):281-5.
[4] Hawkes RA. Enhancement of the infectivity of arboviruses by specific antisera produced in domestic fowls. Aust J Exp Biol Med Sci 1964; 42: 465–482.
[5] Hawkes RA, Lafferty KJ. The enhancement of virus infectivity by antibody. Virology 1967; 33: 250–261.
[6] Halstead SB, O’Rourke EJ. Antibody-enhanced dengue virus infection in primate leukocyte. Nature 1977; 265: 739–741.
[7] Halstead SB, O’Rourke EJ. Dengue viruses and mononuclear phagocytes. I. Infection enhancement by non-neutralizing antibody. J Exp Med 1977; 146: 201–217.
[8] Halstead SB, O’Rourke EJ, Allison AC. Dengue viruses and mononuclear phagocytes. II. Identity of blood and tissue leukocytes supporting in vitro infection. J Exp Med 1977; 146: 218–229.
[9] Peiris JS, Porterfield JS. Antibody-mediated enhancement of flavivirus replication in macrophage-like cell lines. Nature 1979; 282: 509–511.
[10] Peiris JS., et al. Monoclonal anti-Fc receptor IgG blocks antibody enhancement of viral replication in macrophages. Nature 1981; 289: 189–191.
[11] Daughaday CC., et al. Evidence for two mechanisms of dengue virus infection of adherent human monocytes: trypsin-sensitive virus receptors and trypsinresistant immune complex receptors. Infect Immun 1981; 32: 469–473.
[12] Schlesinger JJ, Brandriss MW. Antibody-mediated infection of macrophages and macrophage-like cell lines with 17D-yellow fever virus. J Med Virol 1981; 8: 103–117.
[13] Cardosa MJ., et al. Complement receptor mediates enhanced flavivirus replication in macrophages. J Exp Med 1983; 158: 258–263.
[14] Ross GD. Complement receptors. In Encyclopedia of Immunology, Roitt IM, Delves PJ (eds). Academic Press: San Diego, 1992; 388–391.
[15] Petersen, N.C. and J.F. Boyle. Immunologic phenomena in the effusive form of feline infectious peritonitis. Am J Vet Res 1980; 41:868–876.
[16] Weiss, R.C. and F.W. Scott. Antibody-mediated enhancement of disease in feline infectious peritonitis: comparisons with dengue hemorrhagic fever. Comp Immunol Microbiol Infect Dis 1981; 4:175–189.
[17] Vennema, H., et al. Early death after feline infectious peritonitis virus challenge due to recombinant vaccinia virus immunization. J Virol 1990; 64:1407–1409.
[18] Olsen C.W., et al. Monoclonal antibodies to the spike protein of feline infectious peritonitis virus mediate antibody-dependent enhancement of infection of feline macrophages. J Virol 1992; 66:956–965.
[19] https://www.fox5ny.com/news/feline-coronavirus-treatment-could-stop-spread-of-covid-19-in-humans-doctor-says
[20] Yang ZY., et al. Evasion of antibody neutralization in emerging severe acute respiratory syndrome coronaviruses. Proc Natl Acad Sci U S A. 2005 Jan 18; 102(3): 797–801.
[21] Kam YW., et al. Antibodies against trimeric S glycoprotein protect hamsters against SARS-CoV challenge despite their capacity to mediate FcγRII-dependent entry into B cells in vitro. Vaccine. 2007 Jan 8;25(4):729-40. Epub 2006 Aug 22.
[22] Yip MS., Antibody-dependent infection of human macrophages by severe acute respiratory syndrome coronavirus. Virol J. 2014 May 6;11:82. doi: 10.1186/1743-422X-11-82.
[23] Liu L., et al. Anti-spike IgG causes severe acute lung injury by skewing macrophage responses during acute SARS-CoV infection. JCI Insight 2019;4, e123158.
[24] Yip MS., et al Antibody-dependent enhancement of SARS coronavirus infection and its role in the pathogenesis of SARS Hong Kong Med J 2016;22(Suppl 4):S25-31
[25.] Iwasaki A., et al. The potential danger of suboptimal antibody responses in COVID-19. Nat Rev Immunol. 2020 Apr 21.
[26] Wan Y., et al. Molecular Mechanism for Antibody-Dependent Enhancement of Coronavirus Entry. J Virol. 2020 Feb 14;94(5). pii: e02015-19.
[27] Tetro JA. Is COVID-19 receiving ADE from other coronaviruses? Microbes Infect. 2020 Mar;22(2):72-73.
[28] Li H., et al. SARS-CoV-2 and viral sepsis: observations and hypotheses. Lancet. 2020 Apr 17. pii: S0140-6736(20)30920-X.
[29] Wang S., et al. An antibody-dependent enhancement (ADE) activity eliminated neutralizing antibody with potent prophylactic and therapeutic efficacy against SARS-CoV-2 in rhesus monkeys. bioRxiv. Posted July 27, 2020.
[30] Hoepel W., et al. Anti-SARS-CoV-2 IgG from severely ill COVID-19 patients promotes macrophage hyper-inflammatory responses. bioRxiv. Posted July 13, 2020.
[31] Yasui F., et al. Prior immunization with severe acute respiratory syndrome (SARS)-associated coronavirus (SARS-CoV) nucleocapsid protein causes severe pneumonia in mice infected with SARS-CoV. J. Immunol. 2008;181, 6337–6348.
[32] Wang Q., et al. Immunodominant SARS coronavirus epitopes in humans elicited both enhancing and neutralizing effects on infection in non-human primates. ACS Infect. Dis. 2016;2, 361–376.
[33] Li H., et al. SARS-CoV-2 and viral sepsis: observations and hypotheses. Lancet. 2020 Apr 17. pii: S0140-6736(20)30920-X.
[34] Pierson TC., et al. Structural insights into the mechanisms of antibody-mediated neutralization of flavivirus infection: implications for vaccine development. Cell Host Microbe 2008;4, 229–238.
[35] Yuan FF., et al. Influence of FcγRIIA and MBL polymorphisms on severe acute respiratory syndrome. Tissue Antigens 2005;66, 291–296.
[36] Bolles M., et al. A double-inactivated severe acute respiratory syndrome coronavirus vaccine provides incomplete protection in mice and induces increased eosinophilic proinflammatory pulmonary response upon challenge. J. Virol. 2011;85, 12201–12215.
[37] Du L., et al. The spike protein of SARS-CoV — a target for vaccine and therapeutic development. Nat. Rev. Microbiol. 2009;7, 226–236.
[38] Wang X., et al. Biomimetic inorganic camouflage circumvents antibody-dependent enhancement of infection. Chem Sci. 2017 Dec 1;8(12):8240-8246.
[39] Fu Y., et al. Understanding SARS-CoV-2-Mediated Inflammatory Responses: From Mechanisms to Potential Therapeutic Tools. Virol Sin. 2020 Mar 3.
[40] van Mirre E., et al. IVIg-mediated amelioration of murine ITP via FcgammaRIIb is not necessarily independent of SHIP-1 and SHP-1 activity. Blood. 2004 Mar 1;103(5):1973; author reply 1974.
[41] Veri MC., et al. Monoclonal antibodies capable of discriminating the human inhibitory Fcgamma-receptor IIB (CD32B) from the activating Fcgamma-receptor IIA (CD32A): biochemical, biological and functional characterization. Immunology. 2007 Jul;121(3):392-404.
[42] Cao W., et al. High- Dose Intravenous Immunoglobulin as a Therapeutic Option for Deteriorating Patients With Coronavirus Disease 2019. Open Forum Infectious Diseases 2020;7.
[43] Shao Z., et al. Clinical efficacy of intravenous immunoglobulin therapy in critical patients with COVID-19: A multicenter retrospective cohort study. medRxiv. Posted April 20, 2020.
[44.] 57. Amanat F, Krammer F. SARS-CoV-2 Vaccines: Status Report. Immunity. 2020 Apr 14;52(4):583-589.
[45] Le TT., et al. Evolution of the COVID-19 vaccine development landscape. Nat Rev Drug Discov. 2020 Sep 4. doi: 10.1038/d41573-020-00151-8.
本文来自微信公众号:返朴(ID:fanpu2019),作者:Gene