

扫码打开虎嗅APP
本文来自微信公众号:机器之心(ID:almosthuman2014),原文标题:《“它将改变一切”,DeepMind AI解决生物学50年来重大挑战,破解蛋白质分子折叠问题》,题图来自:视觉中国
CASP14组织者、年近七旬的UC Davis科学家Andriy Kryshtafovych在大会上感叹道,I wasn't sure that I would live long enough to see this(我活久见了)[1]。
11月30日,一条重磅消息引发了科技界所有人的关注:谷歌旗下人工智能技术公司DeepMind提出的深度学习算法“Alphafold”破解了出现五十年之久的蛋白质分子折叠问题。
最新一代算法Alphafold 2,现在已经拥有了预测蛋白质3D折叠形状的能力,这一复杂的过程对于人们理解生命形成的机制至关重要。
DeepMind重大科研突破的消息一出即被Nature、Science等科学杂志争相报道,新成果也立刻获得了桑达尔·皮查伊、伊隆·马斯克等人的祝贺。
科学家们表示,Alphafold的突破性研究成果将帮助科研人员弄清引发某些疾病的机制,并为设计药物、农作物增产,以及可降解塑料的“超级酶”研发铺平道路。
“这是该研究领域激动人心的一刻,”DeepMind创始人、首席执行官德米斯·哈萨比斯说道。“这些算法今天已经足够成熟强大,足以被应用于真正具有挑战性的科学问题上了。”

蛋白质对于生命至关重要,它们是由氨基酸链组成的大型复杂分子,其作用取决于自身独特的3D结构。弄清蛋白质折叠成何种形状被称为“蛋白质折叠问题”。在过去50年里,蛋白质折叠一直是生物学领域的重大挑战。
DeepMind的AlphaFold让人类在这一问题上取得了重要突破。在今年的国际蛋白质结构预测竞赛CASP中,DeepMind开发的AlphaFold最新版本击败了其他选手,在准确性方面比肩人类实验结果,被认为是蛋白质折叠问题的解决方案。这一突破证明了AI对于科学发现,尤其是基础科学研究的影响。
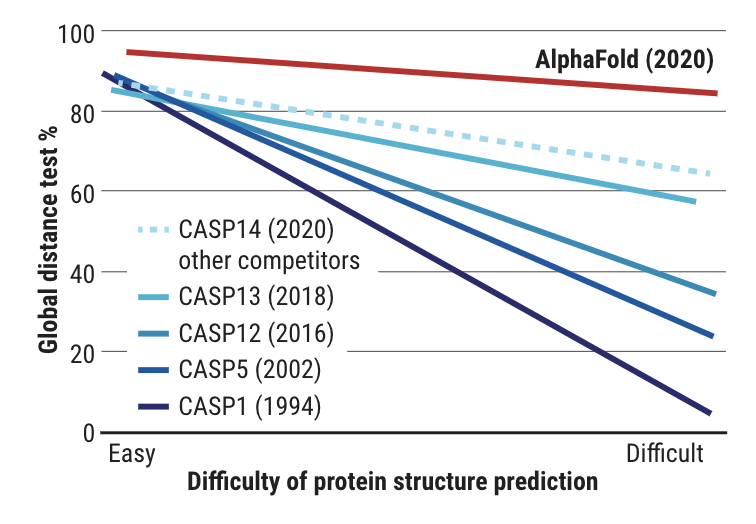
在两年一次的 CASP 竞赛中,各组争先预测蛋白质的 3D 结构。今年,AlphaFold 击败了所有其他小组,并在准确性方面与实验结果相匹配。
对于不熟悉生物领域的人来说,CASP的大名可能有些陌生——CASP全称The Critical Assessment of protein Structure Prediction,旨在对蛋白质结构预测进行评估,被誉为蛋白质结构预测的奥林匹克竞赛。CASP从1994年开始举办,每两年一届,目前正在进行的一届是11月30日开始的CASP14。
而DeepMind这一突破有什么影响?
用哥伦比亚大学计算生物学家Mohammed AlQuraishi在Nature文章中的话来说,“可以说这将对蛋白质结构预测领域造成极大影响。我怀疑许多人会离开该领域,因为核心问题已经解决。这是一流的科学突破,是我一生中最重要的科学成果之一。”
蛋白质折叠问题
蛋白质的形状与它的功能密切相关,而预测蛋白质结构对于理解其功能和工作原理至关重要。很多困扰全人类的重大问题(如寻找分解工业废料的酶)基本上都与蛋白质及其扮演的角色有关。
多年以来,蛋白质结构一直是热门的研究话题,研究者使用核磁共振、X射线、冷冻电镜等一系列实验技术来检测和确定蛋白质结构。但这些方法往往依赖大量试错和昂贵的设备,每种结构的研究都要花数年时间。
1972年,美国科学家Christian Anfinsen因“对核糖核酸酶的研究,特别是对其氨基酸序列与生物活性构象之间联系的研究”获得诺贝尔化学奖。在颁奖礼上,他提出了一个著名的假设:从理论上来说,蛋白质的氨基酸序列应该可以完全决定其结构。这一假设引发了长达五十年的探索,即仅仅基于蛋白质的一维氨基酸序列计算出其三维结构。
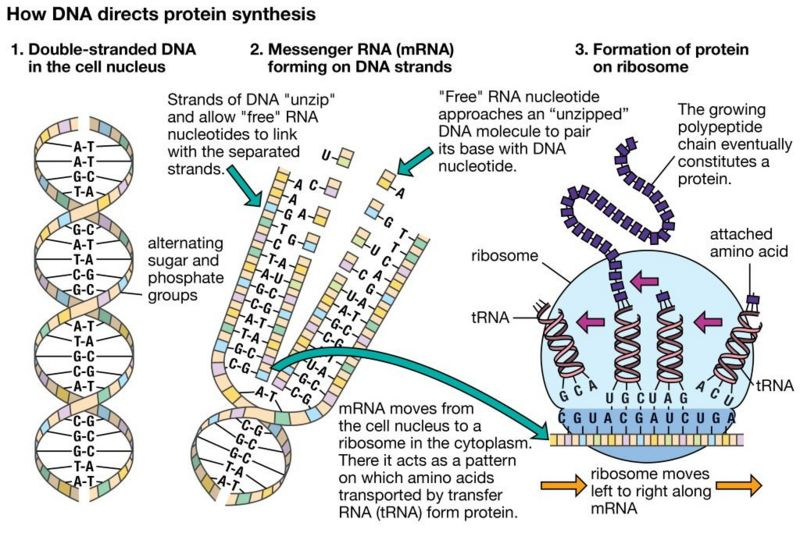
但这一思路的挑战在于,在形成三维结构之前,蛋白质的理论折叠方式是一个天文数字。1969年,Cyrus Levinthal指出,如果使用蛮力计算的方式来枚举一种蛋白质可能存在的构象,要花费的时间甚至比宇宙的年龄还要长。Levinthal估计,一种蛋白质大约存在10300种可能构象。但在自然界中,蛋白质会自发折叠,有些只需几毫秒,这被称为Levinthal悖论。
蛋白质折叠问题解读视频请戳:
CASP 14比赛最新结果:AlphaFold中位GDT高达92.4
CASP竞赛由John Moult和Krzysztof Fidelis两位教授于1994年创立,每两年进行一次盲审,以促进蛋白质结构预测方面的新SOTA研究。
一直以来,CASP选择近期才经过实验确定的蛋白质结构,作为参赛团队测试其蛋白质结构预测方法的目标(有些结构即使在评估时仍然处于待确定状态)。这些蛋白质结构不会事先公布,参赛者也必须对其结构进行盲测,最后将预测结果与实验数据进行对比。正是基于这种严苛的评估原则,CASP一直被称为预测技术评估方面的“黄金标准”。
CASP衡量预测准确率的主要指标是GDT(Global Distance Test),范围从0到100,可以理解为预测的氨基酸残基在正确位置阈值距离内的百分比。John Moult教授表示,GDT分数在90分左右,即可视为对人类实验方法具备竞争力。
在刚刚公布的第14届CASP评估结果中,DeepMind的最新AlphaFold系统在所有预测目标中的中位 GDT 达到 92.4,意味其平均误差大概为1.6埃(Angstrom),相当于一个原子的宽度(或0.1纳米)。即使在难度最高的自由建模类别中,AlphaFold的中位GDT也达到了87.0。
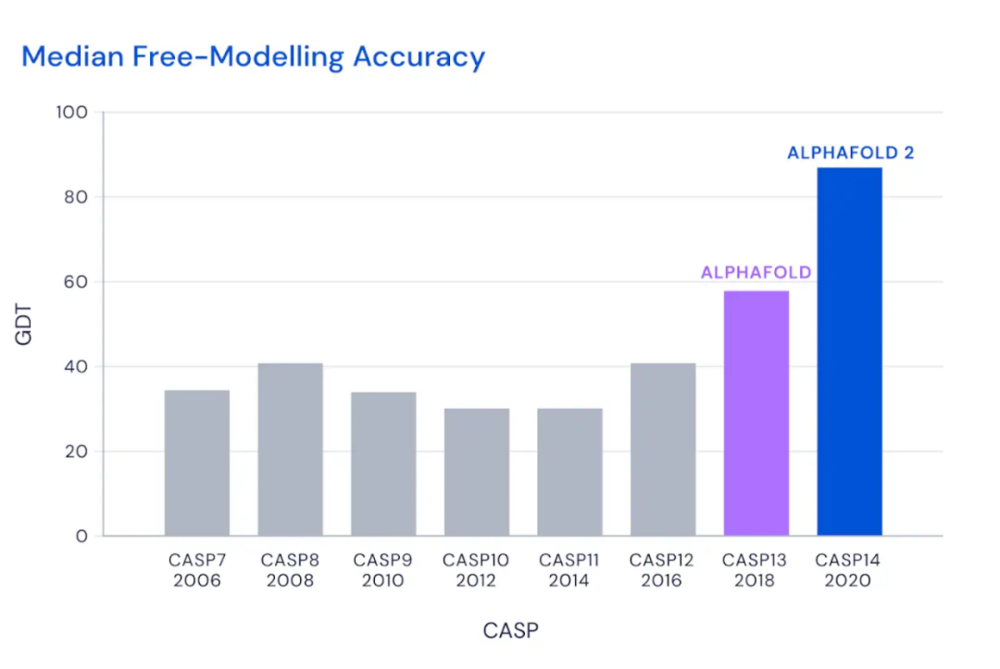
历届 CASP 竞赛自由建模类别中预测准确率中位数的提升情况,度量指标为 BEST-OF-5 GDT。
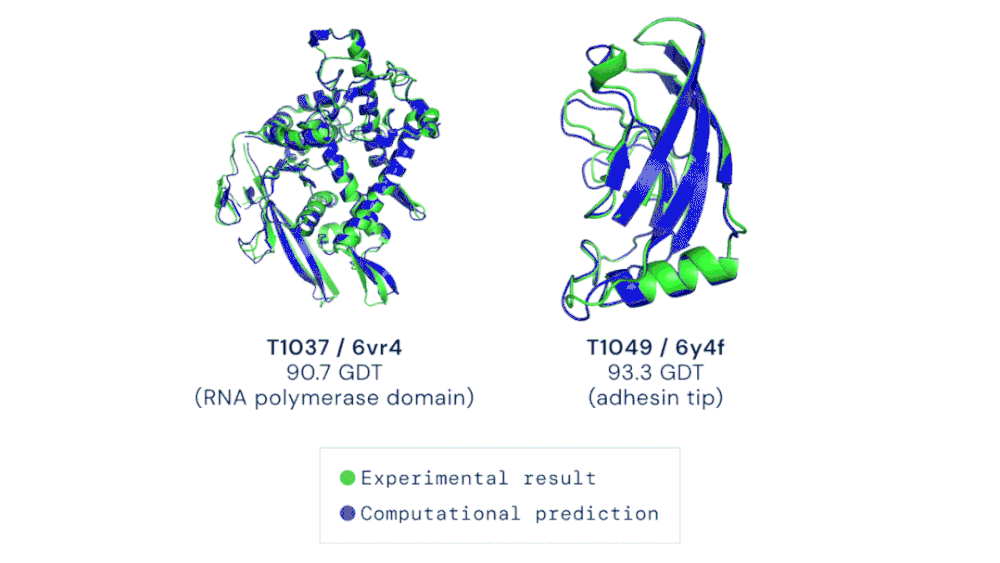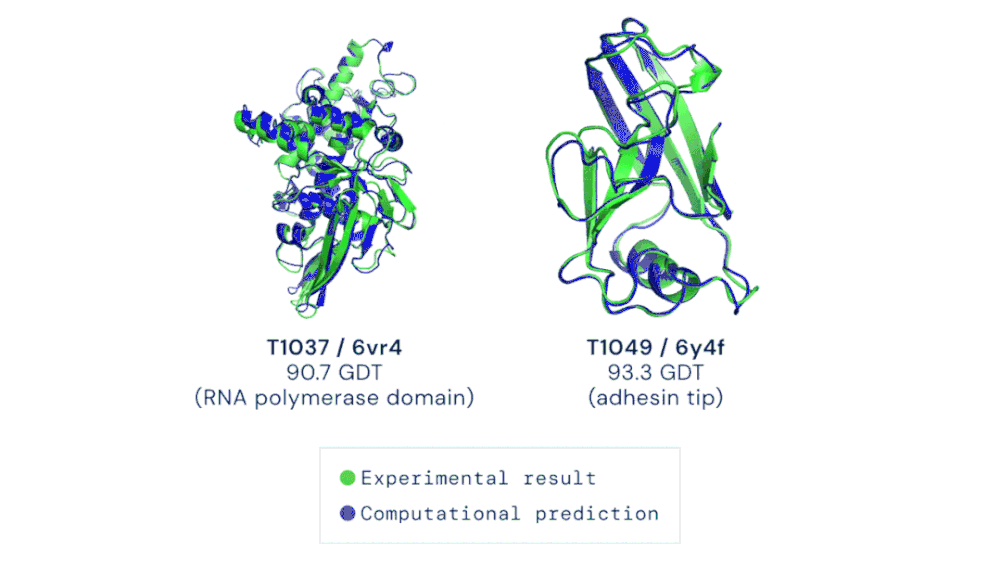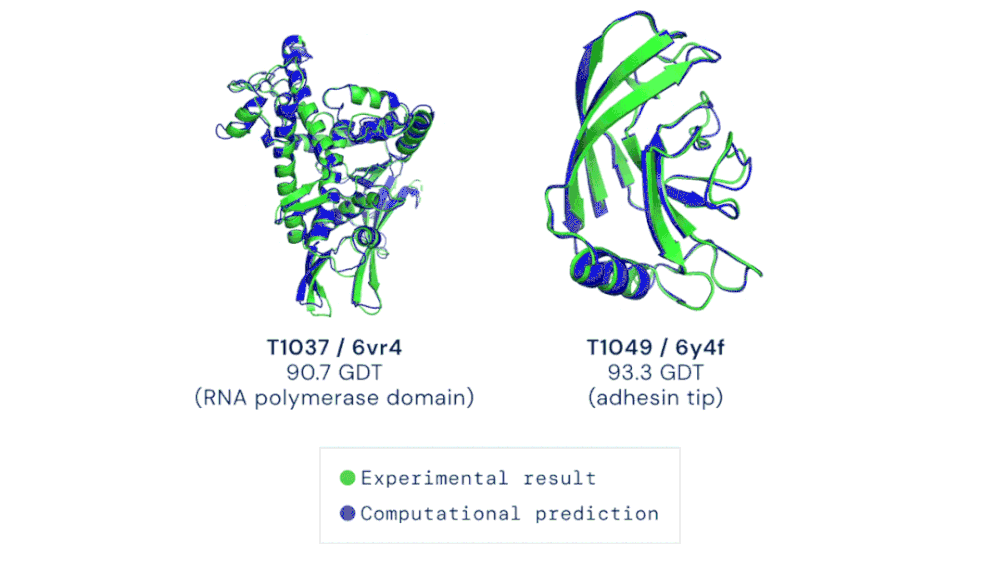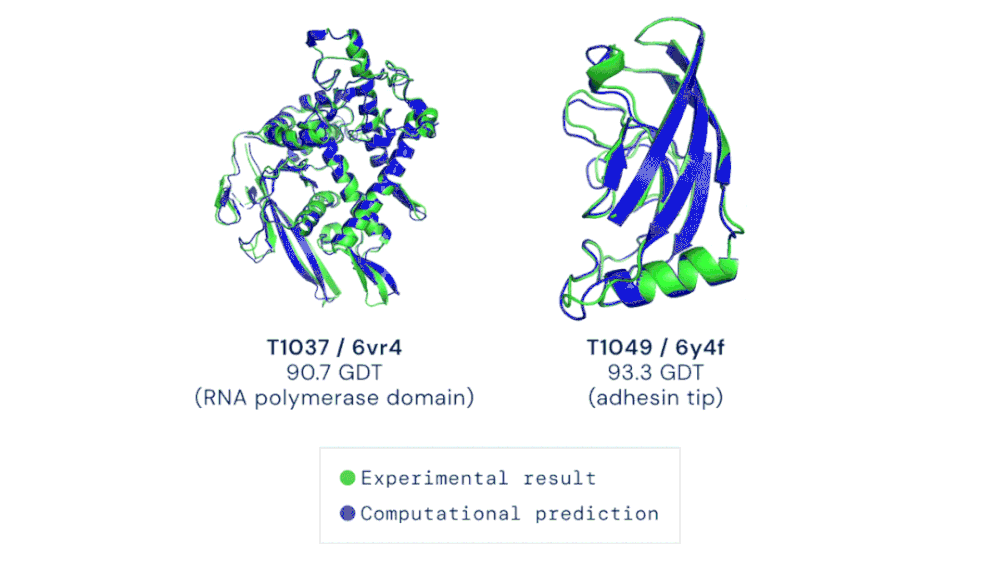
CASP 竞赛自由建模类别中的两个目标蛋白质示例。AlphaFold 能够预测出高度准确的蛋白质结构。
这些令人振奋的结果开启了生物学家使用计算结构预测作为科研主要工具的时代。DeepMind提出的方法对于某些重要的蛋白质类别尤其有用,例如膜蛋白(membrane protein)。膜蛋白很难结晶,因此很难通过实验方法来确定其结构。
该计算工作代表了在蛋白质折叠这一具备 50 年历史的生物学问题上的惊人进展,比该领域人士成功预测蛋白质折叠结构早了几十年。我们将很兴奋,它能从多个方面对生物学研究带来基础性改变。
——Venki Ramakrishnan 教授(诺贝尔奖得主,英国皇家学会会长)
DeepMind这样解决蛋白质折叠问题
2018年,DeepMind团队使用初始版AlphaFold参加CASP13比赛,取得了最高的准确率。之后,DeepMind将CASP13方法和相关代码一并发表在Nature上。而现在,DeepMind团队开发出新的深度学习架构,并使用该架构参加CASP14比赛,达到了空前的准确率水平。这些方法从生物学、物理学、机器学习,以及过去半个世纪众多科学家在蛋白质折叠领域的工作中汲取灵感。
我们可以把蛋白质折叠看作一个“空间图”,节点表示残基(residue),边则将残基紧密连接起来。这个空间图对于理解蛋白质内部的物理交互及其演化史至关重要。对于在CASP14比赛中使用的最新版AlphaFold,DeepMind团队创建了一个基于注意力的神经网络系统,并用端到端的方式进行训练,以理解图结构,同时基于其构建的隐式图执行推理。该方法使用进化相关序列、多序列比对(MSA)和氨基酸残基对的表示来细化该图。
通过迭代这一过程,该系统能够较强地预测蛋白质的底层物理结构,并在几天内确定高度准确的结构。此外,AlphaFold还能使用内部置信度度量指标判断预测的每个蛋白质结构中哪一部分比较可靠。
DeepMind团队在公开数据上训练这一系统,这些数据来自蛋白质结构数据库(PDB)和包含未知结构蛋白质序列的大型数据库,共包括约170,000个蛋白质结构。该系统使用约128个TPUv3内核(相当于 100~200个GPU)运行数周,与现今机器学习领域出现的大型SOTA模型相比,该系统所用算力相对较少。
此外,DeepMind团队透露,他们准备在适当的时候将这一AlphaFold新系统相关论文提交至同行评审期刊。
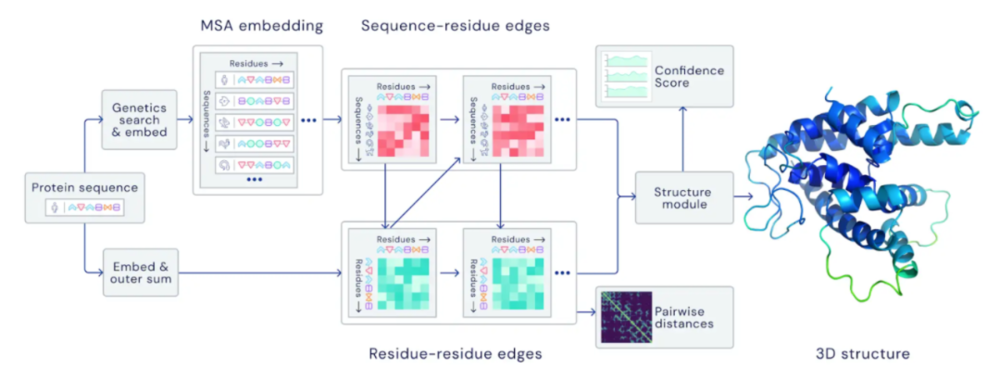
AlphaFold 主要神经网络模型架构概览。该模型基于进化相关的蛋白质序列和氨基酸残基对运行,迭代地在二者的表示之间传递信息,从而生成蛋白质结构。
对现实世界的潜在影响
“让AI突破帮助人们进一步理解基础科学问题”,经过4年的研究攻关,现在AlphaFold正在逐步实现DeepMind初创时的愿景,在药物设计和环境可持续性等领域都产生了重要的影响。
马克斯·普朗克演化生物学研究所所长,CASP评估员Andrei Lupas教授表示:“AlphaFold的精确模型让我们解决了近十年来被困扰的蛋白质结构,重新启动关于信号如何跨细胞膜传输的研究。”
DeepMind表示愿与其他研究者合作,以进一步了解AlphaFold在未来几年的潜力。除了作用于经过同行评审的论文以外,DeepMind还在探索如何以最佳的可扩展方式为系统提供更广泛的访问可能。
同时,DeepMind的研究者还研究了蛋白质结构预测如何帮助人们理解一些特殊的疾病。例如,通过帮助识别存在故障的蛋白质,并推断其相互作用的方式,来理解一些疾病的原理。这些信息能够让药物开发更加精确,从而补充现有的实验方法,并更快找到更有希望的治疗方法。
AlphaFold是十分卓越的,它在预测结构蛋白质的速度和精度上有着惊人的表现。这一飞跃证明了计算方法对于生物学中的转换研究,加速药物研发过程都具有广阔的前景。
同时许多证据也表明,蛋白质结构预测在未来的大流行应对上是有用的。今年早些时候,DeepMind使用AlphaFold预测了包括ORF3a在内的几种未知新冠病毒蛋白质结构。在 CASP14中,AlphaFold预测了另一种冠状病毒蛋白质ORF8的结构。目前,实验人员已经证实了ORF3a和ORF8的结构。尽管具有挑战性,并且相关序列很少,但与实验确定的结构相比,AlphaFold在两种预测上都获得了较高的准确率。
除了加速对已知疾病的了解,AlphaFold还具备很多令人兴奋的技术潜力:探索数亿个目前还没有模型的数亿蛋白质,以及未知生物的广阔领域。由于DNA指定了构成蛋白质结构的氨基酸序列,基因组学革命使大规模阅读自然界的蛋白质序列成为可能——在通用蛋白质数据库(UniProt)中有1.8亿个蛋白质序列。相比之下,考虑到从序列到结构所需的实验工作,蛋白质数据库(PDB)中只有大约170000个蛋白质结构。在未确定的蛋白质中可能有一些新的和未确定的功能——就像望远镜帮助人类更深入的观察未知宇宙一样,像AlphaFold这样的技术可以帮助找到未确定的蛋白质结构。
开创新的可能
AlphaFold是DeepMind迄今为止取得的最重要进展之一,但随着后续科学研究的开展,依然有很多问题尚待解决。DeepMind预测的结构并非全部都是完美的。还有很多要学习的地方,包括多蛋白如何形成复合体,如何与DNA、RNA或者小分子交互,以及如何确定所有氨基酸侧链的精确位置。此外,在与他方合作的过程中,还需要学习如何以最好的方式将这些科学发现应用在新药开发以及环境管理方式等诸多方面。
对于所有致力于科学领域中计算和机器学习方法的人而言,像AlphaFold这样的系统彰显了AI作为基础探索辅助工具的惊人潜力。正如50年前Anfinsen提出的远超当时科研能力所及的挑战一样,这个世界依然有诸多未知的方面。
DeepMind取得的这一进展令人们更加坚信,AI将成为人类扩展科学知识边界的最有用工具之一,同时也期待未来多年的艰苦工作能够带来更伟大的发现。
AlphaFold 科研突破相关视频请戳:
[1] https://zhuanlan.zhihu.com/p/315497173
原文链接:https://deepmind.com/blog/article/alphafold-a-solution-to-a-50-year-old-grand-challenge-in-biology
本文来自微信公众号:机器之心(ID:almosthuman2014)
