

扫码打开虎嗅APP
本文来自微信公众号:返朴(ID:fanpu2019),作者:何笑松(加州大学戴维斯医学院退休教授),原文标题:《不愿参与儿童临床试验,她在事业巅峰放弃了科研 | 丧钟何时鸣响(2)》,题图来自:视觉中国
上一期《脊灰疫苗简史(一):美国人最恐惧的病毒,怎么消灭》讲到,人类对脊灰病毒发起的第一次反击失败了。十年生聚,十年教训,第一支安全有效的脊灰疫苗终于问世,试验结果报告会盛况空前,万众欢呼。一支疫苗,将要改变多少孩童的命运,又影响了多少研究者的一生……
01 他山之石,可以攻玉
科尔默和布罗迪的脊灰疫苗临床试验失败之后,整整二十年间,没人敢于再作同样的尝试。尽管如此,这期间其它病毒疫苗的研究,以及脊灰病毒领域其它工作的进展,为脊灰疫苗的最终诞生铺平了道路。
詹纳发明牛痘疫苗130年、巴斯德发明狂犬疫苗50年后,针对人类病毒的第三种疫苗问世,这就是黄热病疫苗。黄热病是一种通过蚊子携带的病毒传播的急性传染病,患者的肝脏受到损害,出现黄疸,黄热病因此得名。由于病毒造成广泛的内脏出血,因此又名病毒性出血热。
黄热病的死亡率高达50%。1793年,美国当时的首都费城发生一次黄热病大暴发,夺走了全城五万居民中十分之一的性命。1853 年美国新奥尔良的黄热病暴发更是造成30%的居民死亡。其恐怖程度,不下于近年来西非出现的另一种病毒性出血热——埃博拉病毒出血热。直到今天,黄热病还流行于非洲和中南美洲的热带地区。
1930年代,纽约洛克菲勒研究所的病毒学家蒂勒(Max Theiler) 正在研究黄热病毒。他发现来自病人的黄热病毒可以在小鼠的大脑中生长复制,而经过鼠脑传代培养的病毒可以在体外培养的鸡胚组织中生长,并且,这些病毒失去了感染小鼠内脏器官的能力。既然病毒感染造成的内脏出血是黄热病的主要临床症状和致死原因,那么不能感染内脏的病毒是否就可以作为疫苗使用?
但是,这些经过鼠脑传代的病毒有个问题:它们感染脑组织的能力增强了——这对于疫苗来说显然不是好事。蒂勒与他的同事们继续探索,将病毒在多种不同的组织培养中连续传代,试图消除它们感染神经细胞的能力。
到了1937年,他们发现,先将鸡胚胎的中枢神经系统除去,然后切碎,用来培养病毒,在这样的组织中连续传代89次以后,得到了一个代号为17D的病毒变种,既不能感染内脏器官,也不能感染脑组织。而且这个变种的性状稳定,即使在包含中枢神经系统的鸡胚组织中继续传代培养,也不会恢复其感染神经组织的能力。
1938年,以17D病毒作为黄热病疫苗的临床试验在巴西进行,大获成功。第一种安全有效的弱化减毒活病毒疫苗诞生了。蒂勒首创的方法——在组织细胞中连续传代培养病毒,以降低其致病能力——后来被成功用于开发多种病毒性传染病的减毒活疫苗。蒂勒因黄热病疫苗的工作获得1951年的诺贝尔生理学或医学奖,成为迄今为止唯一因发明疫苗而获诺奖的个人。提名蒂勒作为诺奖候选人的,就是他在洛克菲勒研究所的同事,后来研制成脊灰减毒活疫苗的沙宾[1]。
蒂勒在鸡胚组织中培养黄热病毒时,沙宾也想让脊灰病毒在组织培养中生长。可是脊灰病毒不能感染鸡胚。于是沙宾改用人的胚胎。他从3至4个月的流产死胎取得脑、肺、肾、肝、脾等不同组织,切碎后与脊灰病毒混合培养。结果发现,只有在神经组织中,脊灰病毒才能生长[2]。
沙宾的这项研究虽然实现了让脊灰病毒在人或者动物体外的组织培养中生长,但对于研制疫苗却没有什么实际意义。巴斯德用兔子脊髓制成的狂犬疫苗有一种副作用,发生的频率虽低,后果却十分严重:瘫痪甚至死亡。
这是因为脊髓中的神经细胞轴突外包裹着一层护套,就像电线外面的绝缘层,这层护套的一个主要成分是髓鞘基质蛋白(MBP)。将含有MBP的疫苗注射到人体内,在罕见的情况下,会激发人体免疫系统对MBP的免疫反应,进而将自身神经组织中的MBP误认为外来的入侵者,向它发起攻击,神经组织受损后就造成瘫痪。这也就是巴斯德的狂犬疫苗后来被取代的原因。所以用于制造疫苗的原料不能来自神经细胞,以免被MBP污染。
02 最慷慨的诺奖得主
怎样才能避免使用猴子脊髓,或者人类神经组织,而又方便地得到大量的脊灰病毒,用来制造疫苗?
解决这个问题的,是哈佛医学院的教授安德斯(John Enders)和他的两名研究生,韦勒(Thomas Weller)和罗宾斯(Frederick Robbins)。安德斯的研究兴趣是在体外培养来自动物和人类的各种病毒。在他的指导下,韦勒曾经成功地培养了腮腺炎病毒。
1948年3月30日,韦勒和罗宾斯从一个流产死胎的手臂及肩部取得一些皮肤、脂肪和肌肉组织,剪碎后分装到12个含有营养液的培养瓶中。他们当时正在尝试培养水痘病毒,将病毒加进四个培养瓶中,另外四瓶不加病毒,作为对照。做完这些,还多出四瓶组织,没有用处。
就在此时,安德斯走进实验室,看见两个学生在做的事,就说:“我们冰箱里有些脊灰病毒,要不要也试试?”于是那最后四瓶胚胎组织中就加了脊灰病毒。由于此前沙宾只能在神经组织中成功培养脊灰病毒,实验室里没人指望这四瓶非神经组织中能出现什么奇迹。
此后每隔几天,韦勒从培养瓶中取出一点培养液,检查是否含有病毒。他失望地发现,加了水痘病毒的那四个培养瓶中,没有病毒生长。那么脊灰病毒情况如何?韦勒所用的脊灰病毒是一个能够感染小鼠、使之瘫痪的变异病毒株。他将培养液稀释后接种到小鼠体内,奇迹出现了:小鼠瘫痪了!进一步实验发现,在52天的传代培养过程中,培养液中病毒总数增加的倍数达到10的16次方,这表明脊灰病毒不仅能在所培养的非神经组织中生长,而且复制的程度达到了极高的水平[3]。
此后,师生三人又发现,脊灰病毒还能在人和猴子的其它一些组织细胞中生长,包括来自猴子肾脏的细胞。这一发现的重大意义在于,从此以后脊灰病毒可以从体外培养的细胞中大量地产生,不再需要依靠接种活动物;所用的组织不包含神经细胞,因此不必担心制成的疫苗含有MBP,引起瘫痪和死亡。
除此之外,罗宾斯还发现,体外培养的细胞被脊灰病毒感染后,在显微镜下可见细胞发生收缩,进而死亡。安德斯将这种细胞形态的变化命名为病毒的“细胞毒性效应”[4]。这表明只要用显微镜观察所培养的细胞,就可以迅速判断脊灰病毒的存在,而不再需要费时费力地将病毒注射到动物身上,等候瘫痪发生。
1954年,安德斯、韦勒和罗宾斯三人荣获诺贝尔生理学或医学奖,奖金三人平分。获奖理由是“发现了脊灰病毒在多种组织培养中生长的能力。”是安德斯本人的坚持,使得他的两个学生成为共同获奖者。罗宾斯事后回忆道:“安德斯完全可以成为唯一获奖者,所有的人,包括韦勒和我,都不会认为这有什么不妥。三人共同获奖完全是出于安德斯博士的慷慨大度,这正是他的伟大之处。”
03 首次疫苗研发为何失败?
从1940年代初到1950年代初,美国的脊灰瘫痪发病率呈逐年上升之势,从每年一万例增加到近六万例,直接或间接地影响到几乎每一个美国人的生活。脊灰疫苗的研制刻不容缓。
然而,1931年的一项研究成果,为脊灰疫苗增添了一份不确定性。当年英国的一家病理学期刊上发表了一篇论文[5],标题是“不同脊灰病毒株之间的免疫学差异”。从每个病人身上得到的病毒通常称为一株病毒。论文作者描述了他们的实验:给猴子接种一株已知的脊灰病毒MV,也就是科尔默和布罗迪用来制作疫苗的同一株病毒,使猴子发病。恢复之后,再给猴子接种MV毒株,这一次猴子不再得病,因为猴子经过第一次感染后有了对脊灰病毒的免疫力——这是尽人皆知的事实,不是新发现——但后面的结果就不同了。
作者从一个1928年在澳大利亚死于脊灰的孩子尸体中取出脊髓,接种到已有免疫力的猴子身上,猴子又一次得病了!针对MV病毒的免疫力对这种澳洲的脊灰病毒无效!这一结果告诉我们,自然界中存在着至少两种不同的脊灰病毒。
这篇论文的作者伯内特(Marcfarlane Burnet)和麦克纳马拉 (Jane Macnamara) 来自遥远的澳洲,名不见经传。他们的文章虽然发表了,得到的反应却是信疑参半;直到1935年科尔默和布罗迪的疫苗试验失败后,才逐渐受到重视。如果脊灰病毒感染后诱发的免疫力没有交叉保护作用,以一种病毒制成的疫苗对另一种病毒无效,有效的疫苗就必须包括各种不同的脊灰病毒。
能引起瘫痪的脊灰病毒究竟有多少种?答案直到二十年以后才完全揭晓。
04 巾帼双雄
到了1940年代,脊灰病毒的病理学与免疫学研究终于进入快车道,取得一系列长足的进步。当时的病毒学界乃至整个科学界完全由男性主宰,女性研究人员寥寥无几,出类拔萃者更是凤毛麟爪。却有两位女性病毒学家,犹如夜空中一对明亮的双星,以其骄人的研究成果令世人刮目相看。一位是耶鲁大学的霍斯特曼(Dorothy Horstmann),另一位是霍普金斯大学的伊莎贝尔·摩尔根(Isabel Morgan)。
霍斯特曼从加州大学旧金山医学院毕业,取得医学博士学位。在医学院学习期间,霍斯特曼对传染病的研究产生了浓厚的兴趣。1940年,她申请到范德堡大学医院继续接受住院医生训练,该院的医学总监莫根(Hugh Morgan) 却以她是女性为由不予考虑。
几个月后,由于没有招到足够人选来填充空缺, 莫根给霍斯特曼发去一信,询问对方是否仍对范德堡的住院医生职位有兴趣。此时他已经忘了当初拒绝这位“霍斯特曼博士”的理由了。直到霍斯特曼接受了位置,报到就职以后,莫根见到了一位女士站在面前,这才大吃一惊!
霍斯特曼在范德堡顺利完成了住院医生训练,于1942年加入耶鲁大学医学院的一个脊灰病毒研究团队。当时的病毒学界已经知道脊灰病毒能在消化道复制,但只有在中枢神经系统的感染才造成疾病。然而对病毒是通过怎样的途径进入神经系统,却不甚了然。流行的观点是,病毒由口鼻进入人体到达鼻咽部,随即经由嗅觉通道直接入脑[6]。
霍斯特曼与她的同事们研究的重点是脊灰病毒的传播方式,包括两个方面:一是病毒怎样在人体内迁移,造成瘫痪,即病理学层面的研究;二是病毒怎样在社区内扩散,造成疾病流行,即流行病学角度的研究。霍斯特曼对病毒经由嗅觉通道到达神经系统的主流观念有所怀疑,因此进行了一系列探索,从脊灰病患体内不同的部位分别取得样本,从中寻找病毒。她发现所有病人都能通过粪便排出病毒,说明肠道的确是病毒的主要繁殖场所。而在检查血液样品时,从111名病人采集的血样中只有一份含有病毒,而且是来自一名未发生瘫痪的被感染者。
这个唯一的阳性结果看似一个偶然发生的例外事件。可是霍斯特曼没有轻易放过这个 “例外”。她进一步用猿猴进行实验。给猴子喂食脊灰病毒,第11天以后,猴子开始发生瘫痪。霍斯特曼从喂食病毒的次日开始,定期连续采集血样,注射到其它猴子的脊髓中,观察发生瘫痪的情况,以判断血液中是否含有病毒。终于发现,只有在喂食病毒后的第4到6天,血液中含有能引起瘫痪的病毒[7]。
具体来说,病毒通过喂食进入猴子体内,先在肠道内繁殖扩增,从第4天开始,病毒进入血液。第6天以后,免疫系统开始产生针对病毒的抗体,释放到血液中,与病毒结合, “中和”了病毒的感染能力,以当时的技术水平,也就不可能再探测到病毒的存在了。由于能在血液中测到病毒的间隔短暂,稍纵即逝,所以先前检查的病人血样99%是阴性。而霍斯特曼以其敏锐的洞察力抓住了不及1%的“例外”,终于得到革命性的发现。受到这一研究结果的启发,在被感染后发生瘫痪前的潜伏期病人血液中终于也发现了病毒。
霍斯特曼的研究推翻了脊灰病毒进入人体后直接由鼻咽到达大脑的错误观念。进入体内的病毒是先在肠道繁殖扩增,然后才通过血液循环到达中枢神经系统,感染神经细胞,造成瘫痪的。其重要意义在于,如果在人体接触病毒之前,利用疫苗诱导产生针对脊灰病毒的中和抗体,血液中有了这样的抗体,就可能构成一道屏障,阻断病毒感染神经系统的途径,达到防止瘫痪的目的。
霍斯特曼的工作为脊灰疫苗奠定了理论基础。而通过动物实验为其提供佐证的,就是霍斯特曼的同龄人伊莎贝尔·摩尔根。
伊莎贝尔·摩尔根出生于一个科学家庭。父亲托马斯(Thomas Morgan)因阐明染色体在遗传中的作用而获得1933年的诺贝尔生理学或医学奖,母亲丽莲(Lilian Morgan)也是著名的果蝇遗传学家。摩尔根从斯坦福大学获得博士学位后,首先到洛克菲勒大学研究病毒感染后的免疫反应,随后于1944年加入了霍普金斯大学的一个脊灰研究团队。她与同事通过猴子感染实验,发现人群中流行的野生脊灰病毒有三种,而不是两种类型,每个病毒株感染后诱发的抗体只对同型病毒有保护作用[8]。
摩尔根最重要的工作是将当年布罗迪的尝试[9]向前大大推进一步,用甲醛灭活的脊灰病毒作为疫苗,成功地防止了被脊灰病毒感染的猴子发生瘫痪。在此之前,虽然甲醛已被用来制造灭活流感疫苗,但在其它病毒疫苗则还没有成功的先例。摩尔根试验了不同的化学试剂,证明了甲醛能有效地杀死脊灰病毒。她先给猴子注射不同剂量的死脊灰病毒,测定猴子血液里的中和抗体含量,然后给猴子注射同型活病毒, 观察猴子发生瘫痪的比例。
用这样的方法,她确定了诱导产生保护性中和抗体所需的最低疫苗剂量,同时还发现只注射一次疫苗不足以诱发足够的保护能力,只有重复注射几次,才能充分保护猴子免于发生瘫痪。这也就是疫苗的增强接种,是摩尔根对疫苗领域的重要贡献[10]。
甲醛灭活脊灰疫苗在猴子中试验成功后,研制适用于人类的灭活疫苗就成为顺理成章的下一步。谁来担此重任?摩尔根成为众望所归的不二人选。但出人意料的是,由于脊灰疫苗最重要的保护对象是儿童,这就必然要涉及在儿童中进行一系列临床试验,与此相关的各种风险和不确定因素,令摩尔根极为犹豫不安。
最终,38岁的摩尔根选择了急流勇退,在她的研究生涯达到巅峰的黄金岁月,于1949年离开了霍普金斯大学,随同丈夫迁居外州,从此退出了研究第一线,将大部分时间精力用于相夫教子。同事们惊讶之余,除了表示理解,无不为她惋惜。
1960年,49岁的摩尔根重返课堂,在哥伦比亚大学获得生物统计学的硕士学位,随后就为纽约一所癌症研究所提供咨询服务,直到退休。
1958年,乔治亚州暖泉市建起了一道脊灰名人墙,墙上镶嵌着17座青铜头像,其中15座是对脊灰研究作出重大贡献的杰出科学家,摩尔根(右七)是其中唯一的女性。另外两座分别为在世时曾大力推动脊灰研究的罗斯福总统(右二),和他的一名得力助手奥康纳(Basil O'Connor,右一)。

美国乔治亚州暖泉市脊灰名人墙
当年因身为女性,连个住院医生职位都差点得不到的霍斯特曼,后来成为耶鲁大学医学院有史以来聘任的第一名女性正教授(1961年),耶鲁大学的第一名女性讲席教授(1969年),并于1975年当选美国科学院院士。霍斯特曼终身未婚。去世后,她的肖像进入了耶鲁大学医学院的名人画像廊,成为获此殊荣的第一名女性。
霍斯特曼和摩尔根的成果为脊灰灭活疫苗奠定了基础。摩尔根退出脊灰研究领域后,是谁接着跑完下一棒,最终研制成功人用灭活脊灰疫苗?
05 最后的接力
1947年,出生在一个俄国犹太移民家庭、年仅33岁的萨尔克(Jonas Edward Salk)来到匹兹堡大学医学院就任副教授,急切地希望得到经费来启动他的研究工作。当时在美国有一个全美脊灰基金会,负责筹集并掌管脊灰研究的专项经费。这个基金会是由美国历史上最著名的总统之一,带领美国走出大萧条、赢得第二次世界大战胜利的富兰克林·罗斯福总统亲自倡导成立的。
罗斯福本人是个残障人士,他在39岁时患病造成下肢永久瘫痪,被诊断为脊髓灰质炎(也有后世学者认为这可能是误诊,他的症状更接近于吉兰-巴雷综合症,一种影响神经系统的自身免疫疾病)。萨尔克从这个基金会得到一笔资助,对脊灰病毒进行分型。虽然摩尔根等人已经根据脊灰病毒在猴子体内所诱发抗体的交叉保护能力,发现脊灰病毒有三种类型,但基金会认为,为了研发有效的疫苗,必须确保不存在第四型病毒。萨尔克的课题任务就是证实摩尔根等人的结果。
脊灰病毒的分型工作耗时、费力、枯燥,课题又是重复性的,缺少激动人心的创新之处,因此很少有人愿意承担。萨尔克带领他的团队,花了整整两年时间,检查了世界各地采集的250株脊灰病毒,用了近两万只猴子,终于证实脊灰病毒的确只有三种类型。最常见的Ⅰ型占所有病例的80%,Ⅱ型和Ⅲ型各占10%。脊灰疫苗只需要包含这三型病毒中的每型各一株,就可以预防所有的脊灰病毒感染。
虽然萨尔克只是证实了他人已有的结果,但他在这项课题中表现出来的充沛精力和专注精神,给脊灰基金会留下了深刻的印象。1951年,他从基金会得到了每年20万美元(大约相当于今天的两百万美元)的大笔经费,用来开发脊灰疫苗。
萨尔克与他的团队改良了安德斯的脊灰病毒体外培养技术,为生产脊灰疫苗提供原料。他选用猴子的肾脏细胞来培养脊灰病毒,并且用旋转的玻璃试管代替静止的培养瓶来培养细胞,提高了病毒的产量。萨尔克还用猴肾细胞培养来探测脊灰抗体。把血清和病毒混合后加入细胞中,如果血清中含有足量的抗体,细胞就可以存活生长;如果细胞被病毒杀死,则表明抗体不存在或量太少。在此之前,检测脊灰抗体的唯一办法是将血清和病毒混合后注射到猴子体内,观察猴子是否发生瘫痪。
萨尔克从纽约大学医学院毕业后,曾在密西根大学的弗兰西斯(Thomas Francis)教授指导下从事博士后研究,用甲醛杀死乙型流感病毒,制成灭活乙型流感疫苗。现在,他决定采用同样的方法制作灭活脊灰疫苗,这也就是当年布罗迪尝试过、但没有成功,后来由摩尔根用猴子模型证明确实可行的方法。通过他已完成的脊灰病毒分型研究,萨尔克知道哪一株病毒在细胞中的生长最旺盛,感染猴子以后诱发的抗体水平最高。他就根据这些标准,在三种类型脊灰病毒中的每型各选一株,作为疫苗的原料。
对最常见的Ⅰ型病毒,萨尔克选择的是马奥尼株,这是从俄亥俄州一个名叫马奥尼的孩子身上分离得到的病毒。虽然这株病毒诱发的抗体水平高,但它的感染能力和毒性特别强,用来制作疫苗是否安全,后来引起了很大的争议。
然而当时萨尔克有他的道理:毒性弱的病毒诱发的抗体水平低,疫苗的保护效果可能不够好;而且毒性强表示只要很少量的病毒就能使猴子瘫痪,万一病毒没有完全被甲醛杀死,疫苗中即使只含有极微量的活病毒,接种到猴子体内后也能被发现,这就提高了疫苗质量检测的灵敏度,增加了产品的安全保障。
萨尔克在猴肾细胞中培养出病毒,置于冰水中,加入甲醛处理。然后每隔一段时间,取出一点样品,注射到猴子脑部,观察是否造成瘫痪。他发现甲醛处理大约十天以后,猴子就不再瘫痪,表明病毒已被杀死。为了确保安全,他把处理的时间再延长一至两天。三株病毒中,最难杀死、需时最长的就是Ⅰ型病毒的马奥尼株。
1952年,萨尔克开始对他的灭活疫苗进行初步试验,所用的试验对象是一百多名集中收养的残疾和智障儿童。像这样完全以弱势群体作为临床试验对象,虽然违背今天的临床试验伦理道德标准,但在当时的美国是普遍接受的做法。最初的试验是摸索性质的:甲醛处理10天或者更长,三株病毒疫苗单独或者混合注射,皮下注射或者肌肉注射,等等。得到的结果并不理想:虽然没有发生严重的副作用,但是只有Ⅱ型病毒疫苗诱发了脊灰抗体的产生,Ⅰ型和Ⅲ型疫苗完全没有引起抗体反应。
为了增强疫苗激起免疫反应、诱导抗体产生的能力(即疫苗的“免疫原性”),萨尔克将疫苗与矿物油混合后再作肌肉注射。接种后的儿童对三株病毒疫苗都产生了高水平的抗体。矿物油的作用是延长疫苗在注射部位的肌肉中停留的时间,使免疫系统受到更充分的刺激。类似矿物油的疫苗辅助成分称为疫苗的“佐剂”。目前临床使用的各种疫苗中,就有一些含有不同的佐剂。
矿物油佐剂的作用令萨尔克激动不已,觉得已经大功告成。1953年1月23日,萨尔克在一次会议上报告了他的结果。与会者对萨尔克取得的进展极为兴奋,纷纷敦促他尽快开展大规模临床试验。可是短暂的兴奋很快就被失望取代。
基金会内部有人认为,矿物油佐剂有可能造成难以愈合的脓肿和疼痛,用于儿童不够安全,否决了使用佐剂的方案。尽管萨尔克对含矿物油脊灰疫苗的安全性深信不疑,在当年春季给他本人、他妻子和9岁、6岁、3岁的三个孩子都接种了这种疫苗,最后还是被迫放弃了佐剂,再寻求其它途径来增强疫苗的免疫原性。
令萨尔克始料不及的是,嗅觉灵敏的媒体得悉他的疫苗初步试验结果后,当即大肆宣告脊灰疫苗已经诞生。在饱受脊灰蹂躏,每日每时眼见儿童沦为脊灰牺牲品的公众看来,发明疫苗的萨尔克就是拯救世界的英雄。萨尔克不得不在来自脊灰基金会和公众舆论的双重压力下,设法尽快解决灭活脊灰疫苗免疫原性不足的问题。
1953年的3月到10月,萨尔克带领他的团队探索了一系列无先例可循的方案。他将用来灭活脊灰病毒的甲醛浓度从1/250降低到1/4000,处理的温度从0℃提高到37℃。为了掌握甲醛处理的时间长短,他通过反复试验,总结出残余活病毒量的对数与灭活时间二者之间存在线性关系。
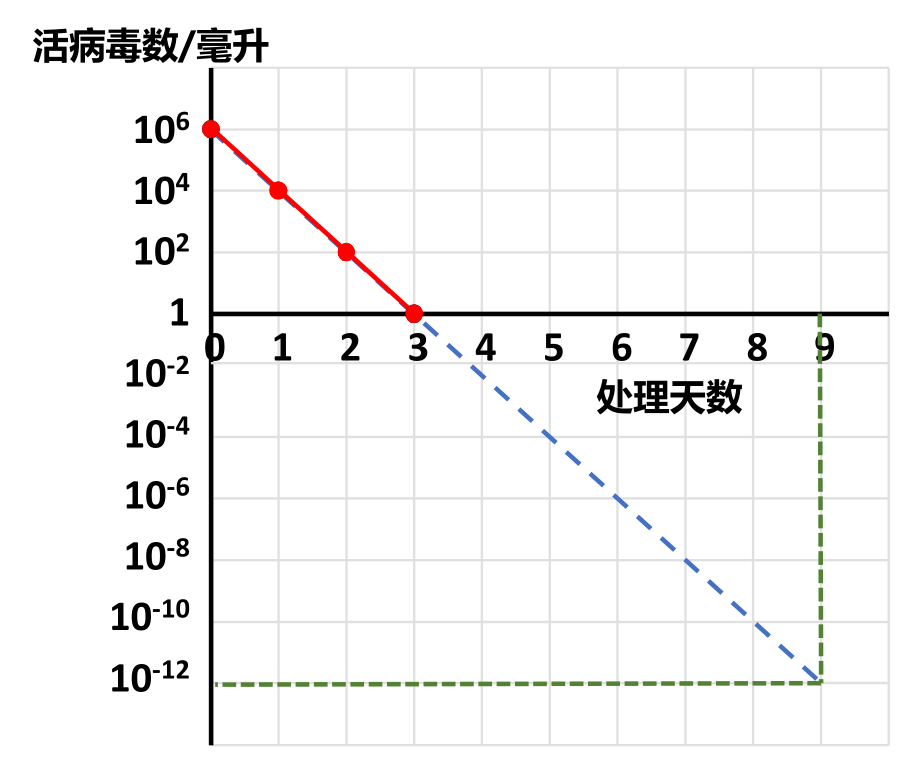
活病毒数量的对数与灭活时间的线性关系(作者作图)
如上图所示,假定造成感染所需的最低活病毒数为1(实际所需的数量可能远远大于1,但这不影响以下的分析),每一剂疫苗的体积为1毫升,其中所用的原料活病毒是100万(106)个,经过甲醛处理24小时后,活病毒减少到1万个,即原来的百分之一;48小时后,减少到100个,即万分之一;处理72小时,即3天后,每毫升疫苗中就只剩下一个活病毒,是原来的一百万分之一,其它病毒都被甲醛杀死了。此时将1毫升疫苗注射到猴脑或者加入培养的猴肾细胞,仍然会使猴子瘫痪,细胞死亡。在坐标纸上以处理时间为横轴,活病毒量的对数为纵轴,所标出的四个点形成一条直线[11]。
萨尔克推断,在残余活病毒量的对数与灭活时间的线性关系保持不变的情况下,再处理3天后,每100万毫升(100万剂)疫苗中才会有一个活病毒。如果总的处理时间达到9天,那么每1万亿(1012)剂疫苗中才能有一个活病毒,1万亿剂疫苗足够给当年地球上的全人类每人接种400次,无论如何都应该算是绝对安全了。
到了1953年秋季,根据萨尔克所取得的进展,全美脊灰基金会认定大规模临床试验的时机已经成熟。此前的1952年是美国有史以来脊灰疫情最严重的一年,全美国一共有58000人瘫痪,可是按人口比例来说则只占0.03%。这就意味着,为了可靠地判断疫苗究竟是否能有效地防止儿童患病,至少必须用几十万人来做接种试验。萨尔克的实验室可以生产足够的疫苗供应几百人的初步试验,却绝对应付不了几十万人的临床试验所需。基金会只能依靠拥有足够疫苗生产设备和能力的大药厂。
基金会一共找到五家有意生产脊灰疫苗的美国公司,萨尔克的任务是将他的疫苗生产技术转移到这些公司,协助公司实现量产。公司要求他提供大规模生产灭活脊灰疫苗的详细工艺流程,包括专用设备的规格型号等等,可是萨尔克无法提供这些细节。
在他看来,自己所能做的,就是尽可能清楚地解释每一个步骤所涉及的原理,以及所要达到的目标。为此他准备了一份55页的文件,其中包括有关残余活病毒量与甲醛处理时间线性关系的详细说明;至于怎样达到这些目标,则应由各家公司根据自身情况,制定出实施细则。但在公司看来,这无异于让他们从零开始摸索,“每个批次的投产都像是一个研究课题。”
技术转移的过程进行得很不顺利。不止一家公司在扩大规模后生产的疫苗中含有活病毒。为了确保疫苗的安全,脊灰基金会规定,每家厂商生产的每一批次的疫苗都必须通过三次质量检查,分别由生产厂家、萨尔克的实验室、以及负责监管全美疫苗生产使用的国立卫生研究院(NIH)生物制品实验室进行。除此之外,只有连续生产了11个批次的合格疫苗的厂家,才有资格为临床试验提供疫苗产品。相互竞争的五家公司中,率先达到这条标准的,是生产疫苗经验最丰富的派德( Parke-Davis)公司和礼来(Eli Lilly)公司。
06 “谢谢您,萨尔克医生!”
1954年4月16日,举国瞩目的脊灰灭活疫苗临床试验正式开始。当时的一项盖洛普民意测验表明,知道这次疫苗试验的美国人数目,比能够正确说出现任美国总统艾森豪威尔全名“Dwight David Eisenhower”的人还多。试验设计为随机双盲法对照试验, 42万名儿童作为试验组,接种派德或者礼来公司生产的疫苗;20万名儿童作为对照组,注射安慰剂;另有120万名儿童不接受任何注射,仅作为观察对象。上午九时,弗吉尼亚州一名6岁的男孩第一个接受了注射。小朋友本人、他的父母、以及给他注射的护士,都不知道打进他上臂肌肉的是疫苗还是安慰剂。
参加这次试验的是小学一至三年级学生,总数为182万,是有史以来美国所进行过的所有医药产品临床试验中规模最大的一次。试验一共动用了美国48个州的2万名医生和卫生官员,4万名注册护士,1万4千名小学校长,5万名教师,以及20万名义工。疫苗试验组和安慰剂对照组的孩子每人在左臂三头肌接受三次注射,前后历时5周;作为奖励,每个孩子得到一支棒棒糖,一个印着“脊灰先锋”的纪念章,外加一次避免脊灰瘫痪的机会。
试验的结果清楚地表明疫苗的保护作用:182万受试者中当年共有16人死于脊灰,无一接种过疫苗;36人因患严重脊灰发生呼吸衰竭,其中仅2人接种过疫苗;此外,未接种疫苗的儿童发生脊灰瘫痪的比例是接种了疫苗的孩子的3.3倍。
那么疫苗的安全性如何?临床试验中设置的注射安慰剂以及不接受任何注射的两个对照组,有助于研究人员判断接种疫苗引起的副作用。虽然在疫苗试验组中也有少数脊灰病例,但都发生在社区中已有脊灰广泛流行之后,瘫痪的部位不在接种的手臂,瘫痪发生的时间与接种的时间无关,说明瘫痪不是由接种疫苗引起的。这一结果令参加试验的所有人员如释重负。
临床试验的总负责人就是当年萨尔克从事博士后研究时的导师弗兰西斯。1955年4月12日上午,试验开始的一年以后,弗兰西斯在密西根州安娜堡的一座会议厅里走上讲台,报告试验结果。台下的500名听众里包括150家报社、电台、电视台的记者,听众席后面架着16台电视摄像机和电影摄影机,全美国有5万多名医生聚集在各地的电影院里,通过闭路电视观看会议实况。人们纷纷打开收音机,商场里设置了大喇叭,法庭上法官暂时停止审判,人人屏声息气地聆听弗兰西斯的报告。
弗兰西斯的报告历时1小时38分。他用一台投影仪,逐一展示了一大堆枯燥无味的数据和图表,最后终于迎来激动人心的结论:疫苗是安全有效的!当他结束报告,走下讲台时,会场里响起的掌声多少还有几分节制,会场外却已是教堂钟声齐鸣,学校老师和学生家长喜极而泣,一家商店老板在橱窗中打起一条横幅,上面写着“谢谢您,萨尔克医生!”

萨尔克(1914-1995)
弗兰西斯之后的几个发言人都表达了对疫苗简短但热情的赞誉。轮到萨尔克上台时,全场起立鼓掌,向他致敬。
但萨尔克对临床试验的结果其实有几分失望。他觉得疫苗还有改进的余地,而且如果对接种的时间间隔做一些修改,产生的抗体水平也许会更高,维持时间更长,保护效果更好。于是他在发言中一五一十地说出了自己的不同观点。但他没有意识到,自己的发言与会场内外的气氛格格不入,可以说是大煞风景,不合时宜。下台之后,连弗兰西斯都恼怒地对他说,“你搞的什么鬼,为什么说那些话?难道你还想要百分之百的保护效率?”
第二天,《纽约时报》以“萨尔克脊灰疫苗的成功”为题,报道了安娜堡的这场新闻发布会:“萨尔克疫苗试验的正式结论……在一个更像好莱坞首映仪式、而不是医学会议的场合,大张旗鼓地公布了。”
出乎所有人的意料之外,仅仅过了半个月,萨尔克在安娜堡被戴上的桂冠,瞬间转变为沉重的枷锁。
参考文献:
[1] Norrby E. Yellow fever and Max Theiler: the only Nobel Prize for a virus vaccine. J Exp Med. 2007; 204: 2779-84.
[2] Eggers HJ. Milestones in early poliomyelitis research (1840 to 1949). J Virol. 1999; 73: 4533–5.
[3] Enders JF et al. Cultivation of the Lansing strain of poliomyelitis virus in cultures of various human embyronic tissues. Science. 1949; 109: 85-7.
[4] Robbins FC et al. Cytopathogenic effect of poliomyelitis viruses in vitro on human embryonic tissues. Proc Soc Exp BioI Med. 1950; 75: 370-4.
[5] Burnet FM & Macnamara J. Immunological differences between strains of poliomyelitic virus. Br J Exp Pathol. 1931; 12: 57–61.
[6] Horstmann DM. The poliomyelitis story: a scientific hegira. Yale J Biol Med. 1985; 58: 79-90.
[7] Horstmann DM. Poliomyelitis virus in blood of orally infected monkeys and chimpanzees. Proc Soc Exp Biol Med. 1952; 79: 417-9.
[8] Bodian D et al. Differentiation of types of poliomyelitis viruses; the grouping of 14 strains into three basic immunological types. Am J Hyg. 1949; 49: 234-45.
[9] Brodie M. Active Immunization in Monkeys Against Poliomyelitis with Germicidally Inactivated Virus. J Immunol. 1935; 28: 1-18.
[10] Morgan IM. Immunization of monkeys with formalin-inactivated poliomyelitis viruses. Am J Hyg. 1948; 48: 394-406.
[11] Offit PA. The Cutter Incident: How America’s first polio vaccine led to the growing vaccine crisis. New Haven and London: Yale University Press, 2005.
本文来自微信公众号:返朴(ID:fanpu2019),作者:何笑松(加州大学戴维斯医学院退休教授)
