

扫码打开虎嗅APP
本文来自微信公众号:量子位(ID:QbitAI),作者:明敏、博雯,题图来自:视觉中国
你可能听说过,DNA损伤得不到修复,就很有可能引发基因突变甚至癌变。
但当看完这句话的时候,你体内的DNA已经至少损失上万次了。
没错,DNA损伤其实每时每刻都在发生。
而且在清醒状态下,这种损伤还会越积越多。
不过先别慌,因为这也不是不能解决的事——只要睡一觉就可以了。
Cell子刊《Molecular Cell》的一项最新研究表明:包括人在内的多种生物平时积累的DNA损伤,会在睡眠状态下被加速修复。
换句话说,当我们睡着以后,身体里的细胞会赶紧出工,把白天“饱经风霜”的DNA修修补补,让它回归到正常状态。
甚至我们为什么会犯困,也和这个有关系。
当DNA损伤到达上限后,大脑会赶紧发出信号喊我们来睡觉。
所以,想睡觉这事儿,还真不是我们自愿的。
这不网友就说:终于找到不加班的理由了,不然我断开的DNA无法修复。
大脑喊你睡觉了
其实DNA发生损伤是一种无法避免的生命现象。
当白天大家需要工作、学习、活动时,紫外线、X射线等因素都会对DNA造成影响。
甚至大脑有时为了加速学习,还会主动让神经元中的DNA自断双链,让所需的基因快速表达。
但是这些小损伤背后可能带来的确实大隐患,基因突变、癌变都可能是由它所引起的。
因此,修复这些损伤就变成了至关重要的事情。
尤其是大脑中的神经元细胞,这种细胞在人类成年后就几乎不再更新了,所以出现损伤后,就只能依靠细胞自身能力来小修小补。
但这种自修自补的方法,比普通细胞用分裂的方式修复要慢。
所以,神经元在修复DNA时,往往很难“雨露均沾”。
今年4月份《Science》上的一项研究就表明,神经细胞的修复能力有限,它们往往只能先集中力量优先修复重要的区域。
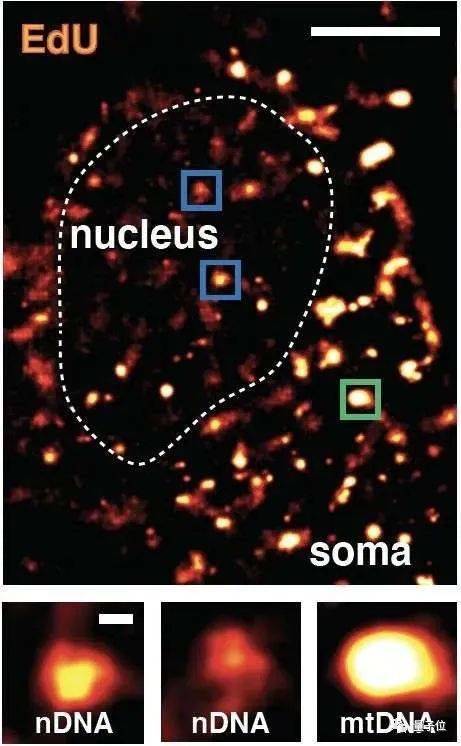
标亮处为集中修复位点
具体什么时候来修复这些损伤呢?
睡觉的时候。
此前,科学家们已经证明,人类睡眠不足会导致血细胞中的DNA损伤增加,同时还会降低修复基因的表达。
但问题的关键是,我们人自己并不知道不睡觉这事儿的严重性。
不然那么多熬夜修仙党是怎么来的(doge)?
所以,为了让我们如此关键的DNA能够及时被修复,大脑想了个办法:
喊你睡觉。
没错,即便没有妈妈催你睡觉,某种程度上你自己也会催自己。
而发挥作用的关键,就是大脑中的PARP1蛋白。
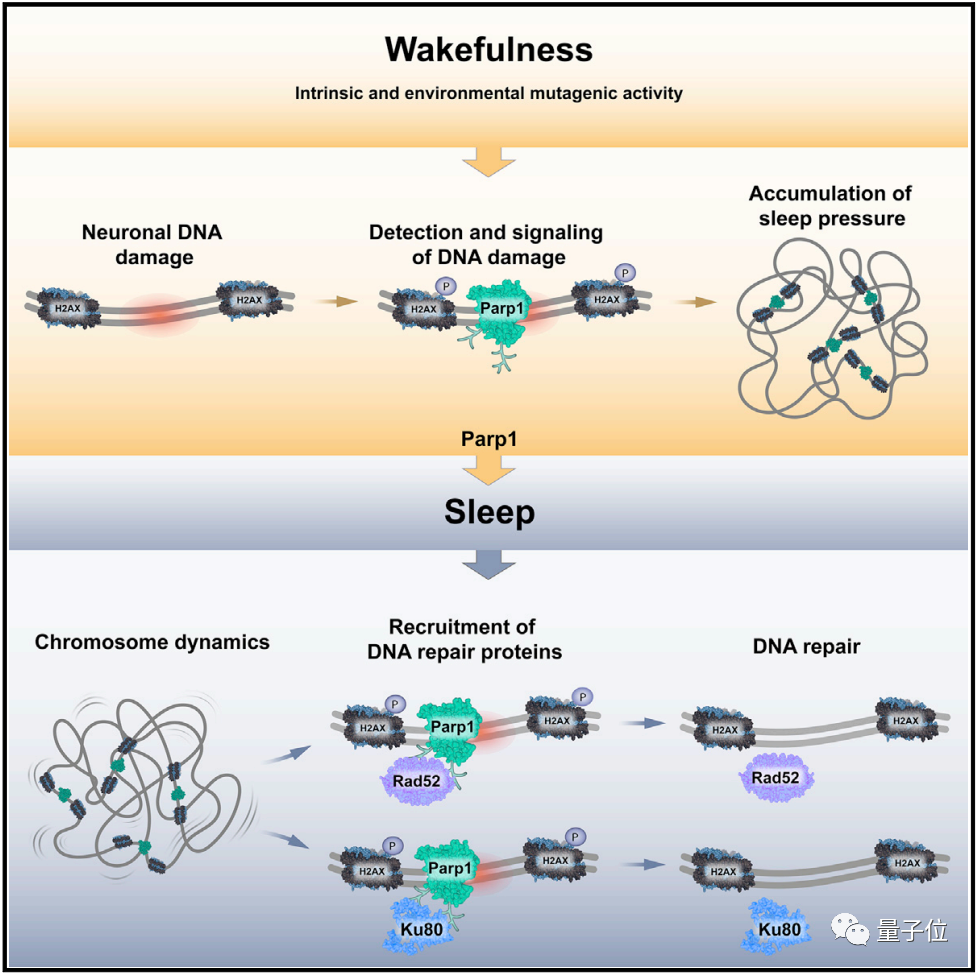
当神经元中的DNA发生损伤时,PARP1蛋白是损伤修复系统中反应最快的蛋白之一,它能生物清醒时就到达损伤的位置进行标记,同时还会让大脑发出催促生物睡觉的指示。
而当生物进入睡眠后,染色体的活动会相应加快。
PARP1蛋白会在损伤位置召集一组可以修复DNA的蛋白Rad52和Ku80,让它们赶紧修复好损伤。
睡眠增加修复蛋白活性
那么科学家是如何证明出来这一论点的呢?
他们在斑马鱼身上做了实验,因为这种动物和哺乳动物的神经系统存在一定相似性。
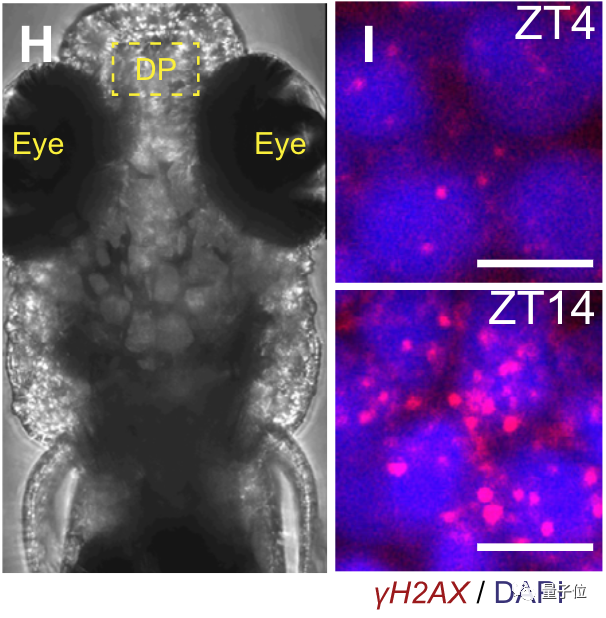
通过控制睡眠时长等方式,研究人员先诱导了斑马鱼体内的DNA损伤,然后监测指标变化。
下图中,亮点表示发生断裂的DNA,ZT4为斑马鱼刚刚睡醒时DNA的断裂情况,ZT14则是在清醒一天后的情况。
可以看出二者的对比非常明显,清醒一天后的损伤量大增。
与此同时,研究人员还检测了修复蛋白Rad52和Ku80的变化。
他们对斑马鱼体内的Ku80-EGFP病灶的数量进行了成像和量化:
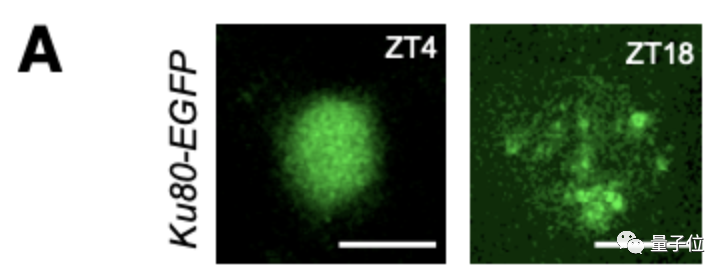
幼体在白天(ZT4)和夜间(ZT18)神经元中的代表图像
可以看到,在白天,Ku80-EGFP病灶数量少,而在夜间,病灶数量增加。
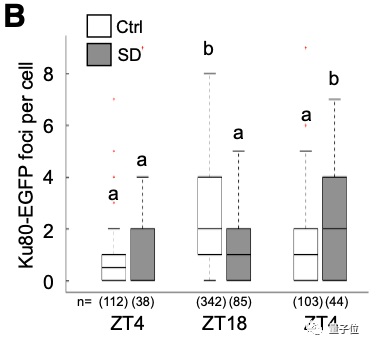
睡眠不足的幼体体内的Ku80-EGFP病灶数量较之对照组较低,而在第二天增加睡眠后,达到了对照组幼体的正常夜间水平。
Rad52蛋白也和Ku80蛋白一样,DsRed-Rad52病灶的数量在白天很低,在夜间增加了约2倍:

SD指睡眠剥夺(sleep deprivation)
最后,研究人员还进一步论证了睡眠所引起的染色体活动,是否真的会影响DNA损伤修复。
团队设置了对照实验来观察修复蛋白Rad52的含量。
实验组不做处理,对照组则添加一种蛋白来抑制染色体的活动。
两组斑马鱼都经历DNA损伤再修复过程。
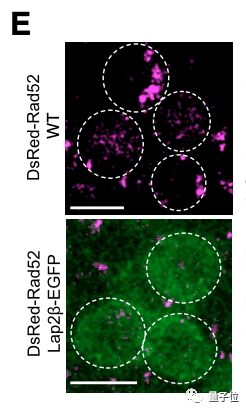
上图为实验组,下图为对照组,粉色标亮处为Rad52蛋白
从图中可以看到,当染色体活动被抑制时,修复蛋白Rad52的含量明显降低。
而对照组在去除掉抑制条件后,修复蛋白含量立即增加1.4倍,到处理后2小时达到2倍的增长。
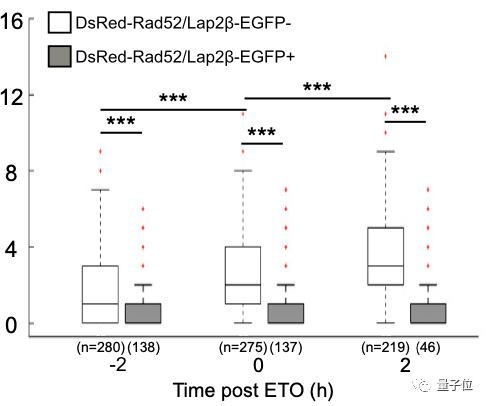
因此可以说,对染色体动态的抑制阻碍了Rad52蛋白修复系统的有效功能。
而之前也有研究表明,睡眠期间染色体活跃程度和DNA受损部位的可及性都有所增加。
因此,睡眠带来的染色体动态的增加能够使得修复活动更加有效。
研究团队在最后表示:
这些发现在细胞层面详细描述了睡眠机制,这种机制可以解释睡眠障碍、衰老和神经退行性疾病之间的联系,如帕金森氏症和阿尔茨海默氏症。
团队介绍
这次的实验基本都在斑马鱼和小鼠身上进行,论文也在最后表示,实验得到的睡眠机制未来也将能扩展到成年哺乳动物和人类身上。
今后我们还将在其他类型的细胞和脑区中进行实验,以进一步从分子层面解析睡眠这一机制。
论文的通讯作者Lior Appelbaum教授这样表示。
他是巴伊兰大学的教授,同样也是巴伊兰大学生命科学与多学科脑研究实验室的负责人。

这一实验室的主要研究领域是大脑的遗传学问题和细胞功能,方向是神经发育和神经内分泌学,尤其关注睡眠方面的问题。
一作David Zada为巴伊兰大学生命科学学院的博士后,同样也是这一实验室的成员。

论文:https://www.sciencedirect.com/science/article/abs/pii/S1097276521009333?via%3Dihub
参考链接:[1]https://www.sciencedaily.com/releases/2021/11/211118203657.htm
本文来自微信公众号:量子位(ID:QbitAI),作者:明敏、博雯
