
扫码打开虎嗅APP

本文来自微信公众号:NeuS (ID:neusmag),作者:郑宸,编辑:光影,题图来自:视觉中国
6月16日,罗氏制药宣布抗阿尔茨海默病(Alzheimer's Disease,AD)临床II期试验API ADAD失败。在该试验中,研究人员给哥伦比亚一个因携带突变基因而极有可能患AD的家族中的1200位成员定期注射候选抗体crenezumab,希望通过减少脑内的β淀粉样蛋白(Amyloid β,Aβ)以预防AD的发生。但在经过长达九年的努力后,治疗组与安慰剂组的疗效却并无显著差异,接受crenezumab治疗并没能延缓认知下降与记忆衰退。
有着3000万患者,3210亿美元市场的抗AD新药研发,曾一度是各大药企的必争之地,但20多年来一次次血淋淋的失败却不断给研发者泼下冷水。2019年11月在国内上市的甘露特钠和2021年6月在美国上市的aducanumab,本应给行业提振士气,但二者至今仍深陷争议,前者拟开展的国际多中心III期试验未能继续,后者又被FDA与医保接连限制。crenezumab的失败对研发者来说无疑又是一记当头棒喝,这也再一次促使人们思考,AD何以因99.6%失败率成为“新药研发之冢”?
1. 靶点迷雾
药物进入人体后需要与靶点结合才能发挥作用,对AD而言,过往的研究多将Aβ作为遏制疾病恶化的靶点。尸检发现患者脑中有大量具有神经毒性的Aβ斑块,科学家便推断将其清除即可改善认识损伤。但现实却是许多药物能有效减少人脑中的Aβ斑块,却不能改善更为重要的认知功能。基于此,研究者又提出Aβ斑块的前体——Aβ寡聚体才是真正杀死神经元的元凶。勉强上市的aducanumab便是作用于Aβ寡聚体,但同样能结合寡聚体的crenezumab和仍然在研的gantenerumab到目前为止却未曾通过任何一项临床试验的检验,反倒是减少Aβ斑块的donanemab上市的希望更大。
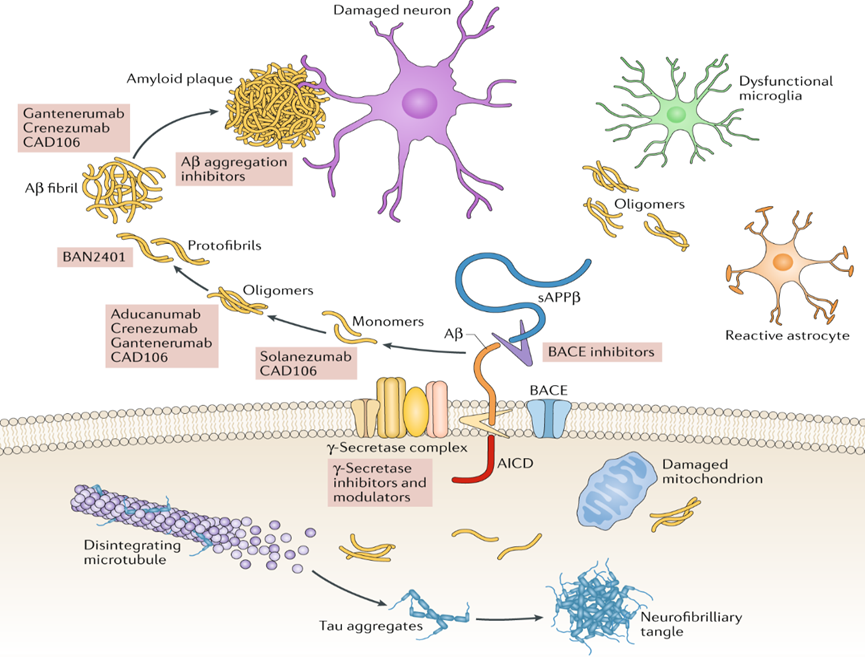
Aβ相关新药研发靶点
Panza, Francesco, et al. "A critical appraisal of amyloid-β-targeting therapies for Alzheimer disease." Nature Reviews Neurology 15.2 (2019): 73-88.
除了斑块和寡聚体,Aβ还存在单体、原纤维、纤维等多种不同的形态,每种形态中Aβ的组成也不尽相同。即便定位到了某一特定种类的Aβ,药物作用在其头部、尾部、中间、还是与之有关的酶都值得考究。毕竟,细节上微小的差异都可能导致药物疗效相去甚远。因此,针对不同Aβ的新药研发仍在如火如荼地进行。
Aβ以外,在研新药还在探索tau蛋白、神经炎症、神经再生、氧化应激、突触可塑性和肠道菌群等数十个潜在靶点。临床前研究中,更有几十上百篇论文宣称发现了改善动物AD模型的新位点。但只有当作用于其上的新药通过III期临床成功上市,一个潜在的药靶才能成为业界公认的靶点。因而在如此纷繁的位点中,只有Aβ勉强能算作靶点,其余仍待验证。
在现行的新药研发范式中,通常只需找准一个靶点即可有效调控病症,如沙坦类药物通过拮抗血管紧张素II受体治疗高血压、他汀类药物通过抑制HMG-CoA还原酶降低血脂,作用机理简单明了。抗AD药物的研发思路多也沿袭这一思路,针对明确的靶点逐一尝试,试图减缓认知衰退。
然而更加复杂的情况是,牵涉到认知和记忆如此复杂的人类精神现象,一个作用点可能远远不够,或许只有做到多管齐下才能有效控制病情。但单靶点的新药研发尚且如此困难,若将数个靶点结合到一起,研发的难度、规模与风险或将超出业界的能力范围。
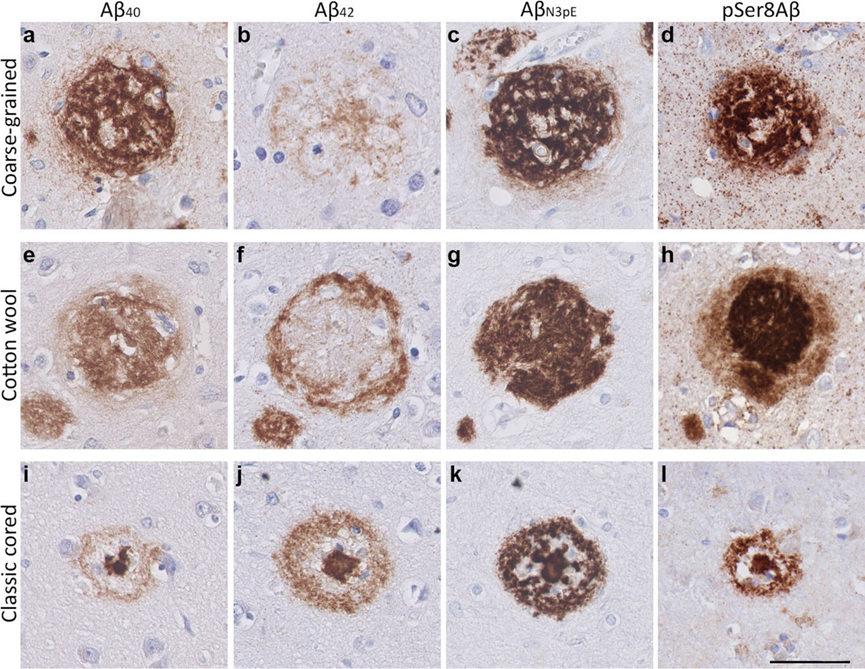
不同类型的Aβ斑块
Boon, Baayla DC, et al. "The coarse-grained plaque: a divergent Aβ plaque-type in early-onset Alzheimer’s disease." Acta neuropathologica 140.6 (2020): 811-830.
2. 临床试验不足
如果说找对靶点是药物有效的前提,那么临床试验就是显现药效的方法。遗憾的是,现行的AD临床试验并不能保证我们能发现每一个有效的分子。
作为一种发病率会随着年龄增长不断攀升的疾病,AD多发于老年群体,已开展的大多数临床试验招募的患者也多为已出现临床症状的高龄患者。然而早在发病前20年,Aβ就已开始在大脑中缓慢积累。等到认知受损再开始干预,就好比患上肺癌才开始戒烟,为时已晚。即使将干预时间提前,药物能不能在有限的试验周期中发挥作用又是另一个问题。
2018年2月,FDA针对AD发布的新药研发行业指南提出,对已存在轻度认知下降的患者可采用认知评估检验疗效,对此前已出现病理改变但认知功能尚未明显受损的患者,可采用Aβ、tau等生物标志物水平的改变来说明药效,后者原则上还可作为获得“加速审批”的基础。抛开量表本身是否能量化被试认知功能的问题不谈,只因受打分者受训程度和从业经验等主观因素影响过大,认识评估便已饱受病垢。而仅靠生物标志物的变化是否足以表征药物改善认知的疗效,也有待进一步的研究提供更加直接的证据。
对于做不到“药到病除”的分子,检验药效的统计方法也会影响候选药物在临床试验中的得分。在aducanumab的研发过程中,渤健曾开展ENGAGE和EMERGE两项为其2-3年的III期试验。经过初步的分析,该药虽然能有效清除Aβ斑块,但并不能显著减缓认知下降,加之高剂量组脑水肿和出血风险分别增加了37%和41%,试验于2019年3月就已终止。但在同年十月,渤健宣布原先的数据分析出错,重新分析后认为EMERGE中高剂量组按10mg/kg给药26周后认识衰退显著减缓,低剂量组亦有减缓趋势,达到了主要与次要终点。修正后的结果最终成为了支持aducanumab获批上市的主要依据。
3. 结语
人类的认知功能是人之为人的基础,是神经科学终极的谜题,同时也是AD蚕食的对象。现行的新药研发框架或许能让我们发现遏制病程进展的药物,但要彻底将其攻克,需要我们在长足的基础研究中厘清认知本身和疾病本质。值得庆幸的是,随着各领域间的融合、研究手段的进步、业界合作的增强,我们有理由相信人类正在朝这个方向不断迈进。
本文来自微信公众号:NeuS (ID:neusmag),作者:郑宸,编辑:光影