

扫码打开虎嗅APP

本文来自微信公众号:Nature Portfolio (ID:nature-portfolio),作者:Aki Stubb、Sara A. Wickström(赫尔辛基大学),头图来自:视觉中国
我们的身体和器官有一道物理和生物化学屏障,这道屏障由外层的上皮组织构成。为了发挥这种至关重要的屏障功能,上皮组织必须迅速适应器官或生物体体积的动态变化,同时保证上皮组织结构的完整性。陈振辉等人[1]在《自然》上撰文报道,斑马鱼幼鱼皮肤中的一群表面上皮细胞(surface epithelial cell,SEC)会在生物体发育过程中出现一种非典型的细胞分裂机制——这种分裂机制并不涉及基因组的复制。
直观上,上皮组织的扩张必须与器官或生物体的生长速度完全匹配——这似乎是显而易见的事。但对这一过程内在机制的研究才刚刚起步。对小鼠皮肤上皮的研究表明,机械张力能触发上皮干细胞的协同分裂[2,3],而细胞拥挤造成的横向压缩则让它们朝着不再分裂的终末分化细胞发展[4]。在这些过程的共同作用下,表皮的扩张能与下层组织的生长需求相匹配。然而,研究人员一直没能在活体内对这种机械力控制的生长过程进行定量分析。
对于发育中的斑马鱼幼鱼来说,它们的表面上皮在许多方面都类似于哺乳动物胚胎的表面上皮。两者都是由基底祖细胞(即位于上皮组织底层的SEC前体细胞)组成的多层结构,这些祖细胞能分化成基底上皮细胞。但是,哺乳动物表面上皮的最外层有一层厚厚的、不透明的死细胞残余物,也叫角化细胞,而斑马鱼的这个表层由分化的SEC活细胞组成,并被黏液覆盖[5]。这使得这些极小的幼鱼通体透明,为高分辨率光学显微镜的周身观测提供了绝佳条件。
陈振辉等人利用斑马鱼皮肤的这一特性,同时结合了名为Palmskin的多颜色活细胞标记的巧妙策略——该策略由团队在Brainbow技术[5]的基础上进行改进而得到。在Palmskin中,多种荧光蛋白组合能在SEC中特异性表达,使作者能够分析细胞形状、追踪细胞谱系,从而研究它们在机体发育过程中的动态变化。
随着斑马鱼幼鱼的生长,其所需的表皮覆盖也会等比例增加。之前的研究表明,这些需求完全是通过基底干细胞或祖细胞的分裂来满足的,而且终末分化的SEC不再进行分裂[6,7]。但是陈振辉等人却观察到大量的SEC分裂,而且这些分裂具有方向性——沿着胚胎生长轴的前-后方向进行。
与之前的研究相呼应的是,该小组并未观察到DNA复制。但他们发现,SEC仍可以在不复制其基因组的情况下进行两轮分裂,最多产生四个子细胞。在这些分裂过程中,DNA含量和细胞大小会成比例下降。作者称这种分裂模式为“无合成分裂”(asynthetic fission),因为它对合成新细胞组分的需求似乎降到了最低(见图1)。
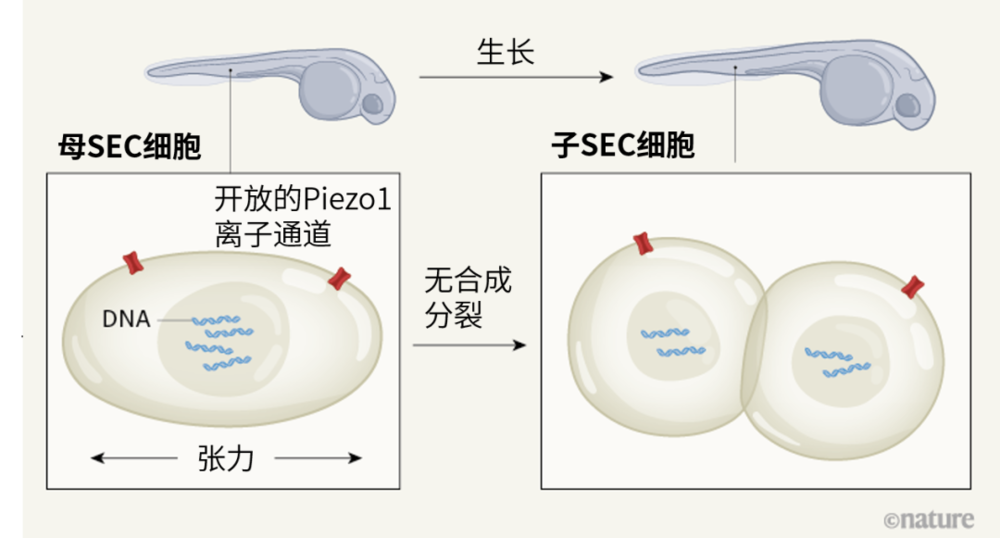
图1|无合成分裂。斑马鱼幼鱼有一个快速生长期,此时其皮肤的表面上皮细胞(surface epithelial cell,SEC)数量必须迅速增加,才能构成生物体与外界之间的保护屏障。陈振辉等人[1]报道,斑马鱼幼鱼皮肤扩张过程中的张力使表面上皮细胞能在不复制其DNA的情况下进行分裂(通过涉及离子通道蛋白Piezo1开放活性的未明机制)。这种“无合成分裂”(asynthetic fission)所产生的子细胞比它们的母细胞更平、更小,DNA等生物材料也比母细胞要少。但是,它们总的表面积更大,能保障对生长中幼鱼的体表覆盖。
作者观察到的这一现象之所以令人诧异,是因为它发生在健康的生物体中。一个进行正常有丝分裂的细胞必须通过多个严格的质量检查点,才能确保DNA被正确复制和分配(到子细胞);在DNA没有完全复制的情况下,这种有丝分裂本不该发生[8]。事实上,此前从未在哺乳动物中发现过这种“未经复制的有丝分裂”。之前的研究表明,某些物种(比如青蛙和果蝇)早期胚胎的细胞在经过DNA复制抑制剂的处理后仍能分裂[9],但无合成分裂的独特之处在于它发生在没有外部干扰的生理学相关过程中。
陈振辉等人发现,在幼鱼发育过程中,无合成分裂会在细胞快速扩增阶段达到高峰——这一阶段对上皮覆盖面积扩增的需求也是最大的。他们还发现,断鳍后的组织再生期间也会触发无合成分裂。作者还通过在不同密度下饲养幼鱼来控制幼鱼的生长速度(在一定量的水中,鱼越多,它们的生长速度就越慢)。这种操控改变了SEC的分裂速率。综合这些数据可知,无合成分裂提供了一种灵活调控上皮表面积的方式。
作者观察到,四个子细胞的总体积与初级母细胞的体积一致。基于这一点,他们用一个简单的数学模型预测,无合成分裂或许能有效增加SEC的表面覆盖度。但令人惊讶的是,一个细胞无合成分裂所需的时间比基底表皮细胞的有丝分裂更久。因此,一个耐人寻味的问题是:与通过拉长、拉平不分裂的细胞以增加覆盖面积的机制相比,无合成分裂的优势在哪里呢?一个可能的答案是:在拉伸方向上发生的细胞分裂能迅速降低组织的机械张力,这一点已经在哺乳动物细胞培养物[10]以及早期斑马鱼胚胎发育中得到证实[11]。
之前研究曾发现上皮拉伸与生长发育之间的关联[2],作者基于这种关联提出假设:生物体生长产生的组织张力通过积累可以控制无合成分裂。这里的一类主要张力传感器是机械敏感性离子通道蛋白,如Piezo1[12]。陈振辉等人发现,在实验中激活Piezo1能显著增加SEC的无合成分裂,而抑制Piezo1基因表达则会减弱分裂。这一结果表明,无合成分裂可能受到Piezo1介导的拉伸感知机制的控制。有意思的是,在Piezo1基因受到抑制的幼鱼中,尽管没有无合成分裂,但身体生长速度完全正常。那么在这些动物中基底祖细胞的分裂速率是否也会增加——作为一种产生更多细胞的补偿机制;抑或是否有其他相应的适应性生长机制参与其中?
接下来的关键工作是详细阐明无合成分裂的机制。陈振辉等人的研究表明,通过化学方法抑制细胞周期检查点或是调控这些检查点的酶,并不会显著影响无合成分裂。但药物处理带来的系统性副作用让实验最多只能持续数小时,无法研究它们对SEC的长期影响。
今后,在SEC中特异地对细胞周期蛋白进行遗传操作的研究分析或有助于鉴定这种分裂模式是否确实不受细胞周期调控和检查点的影响。此外,SEC中由Piezo1信号转导触发的分子机制仍有待确定。最后,这种分裂机制是否存在于其他组织和生物体中也是一个非常有趣的问题。
参考文献:
1. Chan, K. Y. et al. Nature605, 119–125 (2022).
2. Aragona, M. et al. Nature 584, 268–273 (2020).
3. Dekoninck, S. et al. Cell 181, 604-620 (2020).
4. Miroshnikova, Y. A. et al. Nature Cell Biol. 20, 69–80 (2018).
5. Livet, J. et al. Nature 450, 56–62 (2007).
6. Abe, G. et al. Semin. Cell Dev. Biol. 100, 109–121 (2020).
7. Guzman, A. et al. Biol. Open 2, 1179–1186 (2013).
8. Stillman, B. Science 274, 1659–1663 (1996).
9. Kermi, C., Aze, A. & Maiorano, D. Genes 10, 398 (2019).
10. Wyatt, T. P. J. et al. Proc. Natl Acad. Sci. USA 112, 5726–5731 (2015).
11. Campinho, P. et al. Nature Cell Biol. 15, 1405–1414 (2013).
12. Murthy, S. E., Dubin, A. E. & Patapoutian, A. Nature Rev. Mol. Cell Biol. 18, 771–783 (2017).
原文以Stretched skin cells divide without DNA replication为标题发表在2022年4月27日《自然》的新闻与观点版块上
本文来自微信公众号:Nature Portfolio (ID:nature-portfolio),作者:Aki Stubb、Sara A. Wickström(赫尔辛基大学)