

扫码打开虎嗅APP
本文来自微信公众号:CC情报局 (ID:cancer-weekly),作者:张煜(原肿瘤内科医生、凤凰网《肿瘤情报局》特约专家),题图来自:视觉中国
一
2023年1月中,北京大学药学院管晓东教授,分别在Nature(《自然》杂志)和JAMA(《美国医学会杂志》)上发表论文,分析了近15年国内审批上市的抗癌药物的疗效以及总体生存获益情况。
在这项研究中,在2005至2020年间,国内共批准了78个抗癌药物,对应141个适应症,其中20个(25.6%)药物(30个适应症)仅在国内获批。在所有适应症中,有26个(18.4%) 在单臂或剂量优化试验中进行了评估,其中大部分在2017年之后获得批准。到2021年6月30日,34个药物适应症(24.1%)没有记录到“OS增益”(“OS”就是“overall survival”,即总生存期。临床有多种叫法,一般用改善,不用增益,即增加益处的意思),只有68个药物适应症(48.2%)有明确的总生存期获益,中位总生存期的改善是4.1个月(也就是多活4.1月)。
这项研究表明,中国批准的抗癌药物适应症中几乎有一半显示出总生存期增加。

这篇文章于先后不到六个月的时间里,在国外两家顶级医学杂志上发表,引起了国内外的广泛关注。文章中的部分观点迅即在国内网络上爆发,尤其是在一些癌症论坛上,这引发了一些癌症患者对这些抗癌药的疑虑。
有自媒体甚至以震撼性的标题进行了解读,文章题目就是“十几年来中国批准的上百种抗癌药,一半以上没有效果”。
事实真相究竟是怎么回事?国内批准上市的抗癌药物的“总体生存获益”是多少?这一半以上的药物真的对病人无效吗?
二
先解读一下Nature和JAMA杂志上发表的这篇关于“评估中国审批的抗肿瘤药物的总生存期获益”的文章。
看下列附图,管教授在JAMA杂志上发表的论文题目和结论:

题目写得很明确,是评估中国审批的抗肿瘤药物的总生存期获益,看清楚,是总生存期(Overall Survival),结果也写的是:只有68个药物适应症(48.2%)有明确的总生存期获益,中位总生存期的改善是4.1月(也就是多活4.1月),其余的药物适应症没有总生存期获益的明确证据(有多种原因,有些复杂,不分类解读了)。
这里先说一个基础知识:批准药物上市和药物适应症是两码事。一种新药可以有多个药物适应症,都需要国家批准。比如信迪利单抗被批准用于晚期非小细胞肺癌和胃癌,这就是两个药物适应症。
癌症药物治疗的主要目标是延长生命或提高生活质量。总生存期(OS)是最可靠的临床试验终点,可为新抗癌药物的监管批准提供信息。这篇论文其实是对国内这十五年左右时间批准的近百个抗癌新药进行了一次系统检验,即检验这些药物是否达到了”总生存期获益”。
简单地说,管教授的论文重点是研究中国上市的抗癌药物和总生存期获益的关系,不是有没有临床效果。而总生存期没有获益和没有临床效果是完全不同的概念,但很不幸,因为一些自媒体和部分读者缺乏肿瘤的专业知识,直接就误认为这两者是一码事。
很多人不理解,说既然是抗癌,总生存期没有延长,那不就说明完全无效么?那就等同于没有临床效果啊。
答案并非如此:癌症患者从开始进行药物试验治疗到死亡,会经历一个漫长的过程。其中影响的因素非常多,因此试验药物对总生存期的作用经常受到各种干扰因素影响。
一个等待上市的药物,即使用于某种癌症总生存期无获益或者获益很小,但是还有其它的指标可以进行评估,比如无疾病进展生存期(PFS),可以大致理解为用药后肿瘤能被控制的时间,以及治疗后肿瘤缩小好转的比例(有效率),还有生活质量是否改善等,这些都是评估药物的指标。
注意,一个抗癌药物,即使最终没有总生存期的获益,但也很可能出现有效率的明显升高,PFS的明显延长和生活质量的改善,这当然也是药物疗效的一部分。(大家可能不太理解为什么,以后有时间专门写文章讲)
打个比方,管教授明明说的是猫,一些自媒体和部分读者没有读懂,直接按照自己的意思理解为是老虎,这差别就很大了。

这篇研究文章还提出:患者缺乏关于获批抗癌药物益处的有限证据的信息,并且可能对疗效和安全性有误解,从而产生虚假的益处希望并低估风险。监管机构应强制要求在批准的所有药物标签中,统一记录总生存期获益信息,并可以添加清晰的视觉警报标签,类似于 FDA 批准的药物标签中的“黑框警告”(black box warning)。
美国FDA要求,在所有批准的药物中,要在所列的黑框中显示药物的风险提示与重要副作用。目前国家药监局要求,说明书顶端可附警示语,一般也是以黑框形式展现,但目前并没有在药物外包装上显示。
三
不过,这篇研究文章里还写了个事实:国内企业研发的药物并经中国批准上市的30种药物适应症,只有不到1/3(30个里有9个)展示出总生存期的获益,对比美国和欧洲国家,超过50%(111个里有59个,比例53.1%)的上市药物适应症具有总生存期获益。
这可以看出两点:
第一,我们的药物适应症的批准上市比美国和欧洲相对宽松一些。
第二,美国和欧洲批准上市的药物适应症中,也有46.9%的比例是没有总生存期获益的。
所以,无论国内国外,国家批准药物适应症上市,并不是基于总生存期为唯一指标,还有其它多个指标。
再说一遍,没有总生存期获益并不是没有临床效果。

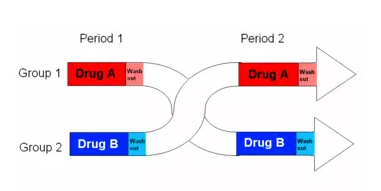
图/临床试验的交叉设计会显著影响总生存期的获益。
什么是临床试验的交叉(crossover)?大致意思是:在临床试验中,当对照组患者使用标准疗法确定无效,同时试验组新药展现疗效的时候,患者可以选择交叉“跨组”,使用新药进行治疗。所以,即使被分到对照组,依然有机会在后续使用新药。这么做带来的结果就是导致了对照组的患者其实也有机会用新药,交叉后总生存期差异就会明显缩小。
四
这篇论文凸显出国内很多抗癌药物的尴尬处境。
即使国家批准药物适应症不需要总生存期获益,但请读者注意,总生存期获益是一个最重要的指标,活的长就是硬道理。
因此,一个药物适应症(指的是一种新药批准用于某种特定肿瘤),显然是能够把总生存期延长得越久越好。在临床试验中,总生存期获益越高,代表药物的疗效越好。总生存期无获益时,其实通常就意味着这个新药的效果不太好,也就是可能PFS和有效率升高,但不能转化为总生存期获益。
大家理解了吧,使用抗癌药物后,总生存期获益是越长越好。总生存期无获益时,仍然可能有临床效果,只是这个临床效果比较一般,明白了么?效果一般,就是这个意思。
从管教授的文章,可以看出国内近10多年批准上市的药物适应症,其实相当多都没有总生存期获益,也就是临床效果很一般。即使有总生存期获益的药物,也仅仅是4.1个月的延长。这也给我们敲响了警钟,癌症治疗还是任重道远,急需更好、更有效的新药。
这是很尴尬的处境。所以癌症患者一定要知道,批准上市的新药其实效果很可能没有大家想象的这么好,只有很少一部分能够很显著的延长总生存期,能多活1年以上的都相当少见。
所以我反复提醒过大家,晚期癌症的治疗,一定要量力而行,避免人财两空。很多批准上市药物虽然临床效果很一般,但是价格却可能相当昂贵,那这种时候患者就要做出合理的选择。

我给大家举个例子,国外上市的特罗凯(也叫盐酸厄洛替尼),一种治疗肺腺癌的靶向药,新批准了一个药物适应症,也就是晚期胰腺癌的治疗,NCCN指南也纳入了。那么对于生存期的获益到底是多少呢?
答案是0.3月,也就是9天。
在一项针对进展期胰腺癌的Ⅲ期临床试验中,对比了化疗和化疗+特罗凯的疗效,结果发现化疗组的中位生存期是5.9月,而化疗+特罗凯组是6.2月,整整延长了0.3月。这种效果是有,但出乎意料的低。
最后,希望大家明白这个道理,即使国家批准上市的新药适应症,疗效也有显著的区别,差异可以很大,所以要结合患者的具体情况选择合理的治疗方案。也希望一些自媒体不要闹出笑话,把总生存期获益等同于临床效果,这并不是一回事。
本文来自微信公众号:CC情报局 (ID:cancer-weekly),作者:张煜(原肿瘤内科医生、凤凰网《肿瘤情报局》特约专家)
