

扫码打开虎嗅APP

本文来自微信公众号:神经现实 (ID:neureality),作者:Ekaterina Pesheva,翻译:Luvia,题图来自:视觉中国
疼痛神经和杯状细胞(goblet cells,一种含有黏液的肠道内细胞)之间有直接的相互作用。在炎症状态下,疼痛细胞刺激杯状细胞释放更多保护性粘液。研究显示,神经系统在维持肠道屏障方面起着关键作用,并能在炎症期间激发人体保护机制。
一直以来,人们都认为疼痛是演化史上用于检测受伤与身体不适的最牢靠的工具之一。疼痛相当于一套警示系统,它的出现提醒我们,是时候停下来关心一下自己的身体状况了。
但如果疼痛不仅仅只是一个警钟呢?如果疼痛本身也是一种保护形式呢?
哈佛医学院的研究者在小鼠身上发现,疼痛本身很可能也在为机体提供保护。
这项研究发表于《细胞》,实验显示,小鼠肠道内的疼痛神经元在正常情况下能够调节保护性粘液的分泌;而在小鼠患炎症时,疼痛神经元则能促进更多粘液的分泌。

Yang, Daping, et al. "Nociceptor neurons direct goblet cells via a CGRP-RAMP1 axis to drive mucus production and gut barrier protection." Cell 185.22 (2022): 4190-4205.
https://doi.org/10.1016/j.cell.2022.09.024
研究详细解释了复杂的信号级联放大(signaling cascade)的步骤,揭示了疼痛神经元与肠道内杯状细胞活动之间直接的相互作用。
哈佛医学院卜拉瓦特尼克研究所(Blavatnik Institute)高级研究员、免疫生物学助理教授艾萨克·邱(Isaac Chiu)说:“事实上,除了探测潜在伤害和给大脑传递信号以外,疼痛可能在以一种更直接的方式保护我们。我们的研究显示,肠道中调节痛觉的神经能够与附近肠道上皮细胞沟通。这意味着,神经系统在肠道中起着重要作用,它不仅仅给人传递不舒服的感觉,还在维持肠道屏障和炎症期间保护机制中扮演关键角色。”
肠道内的直接对话
我们的肠道和呼吸道内布满了杯状细胞。这种细胞得名于它们杯状的外形,杯状细胞内含有蛋白质和糖组成的胶状粘液,可以像保护涂层一样保护脏器表面不受擦伤和损害。最新研究发现,当肠道内的杯状细胞与肠道痛感神经因直接互动而受到刺激时,它能够释放保护性粘液。
在一系列实验中,研究者发现,缺少痛感神经的小鼠肠道内分泌的保护性粘液更少,并且会产生肠道生态失调症(一种肠道内有害和有益菌群组成失衡的症状)。
为了解释这种保护性交互作用是如何产生的,研究者们分析了杯状细胞分别在痛感神经存在和缺失两种情况下的行为。
他们发现,杯状细胞内含有一种叫做RAMP1(Receptor Activity Modifying Protein 1,受体活性修饰蛋白1)的受体,当它周围的疼痛神经由于饮食和微生物信号、机械压力、化学刺激或剧烈的温度变化被激活时,RAMP1能够对这些附近的疼痛神经活动作出反应。
实验进一步表明,疼痛神经在受到刺激后,会释放一种叫做CGRP(Calcitonin gene related peptide,降钙素基因相关肽)的化学物质,杯状细胞的RAMP1受体正是通过与CGRP结合来对周围疼痛神经的活动作出反应。研究者在人类和小鼠的杯状细胞中都发现了RAMP1受体,因此认为人类和小鼠的杯状细胞都能对疼痛信号产生应答。
研究还发现,一些肠道微生物也能够促使疼痛细胞释放CGRP,从而维持菌群的动态平衡。
邱说:“这个发现告诉我们,痛感神经不仅会被急性炎症触发,它们在基线水平上也会有活动。仅仅是日常的肠道细菌就能刺激痛感神经活动,并导致杯状细胞释放粘液。”
邱说道,这种反馈回路确保肠道内的微生物能够刺激到神经元,神经元随之调节粘液释放,而释放出的粘液又能保持肠道微生物健康。
研究还表明,除了微生物作用,饮食因素也能激活疼痛受体。当研究员给小鼠投喂辣椒素(capsaicin,辣椒中能引起剧烈痛感的主要配料)时,小鼠的痛感神经会迅速被激活,令杯状细胞充分释放保护性粘液。
与之相反,缺少疼痛神经或CGRP在杯状细胞中的受体的小鼠更容易患肠炎,这也解释了肠道菌群生态失调的人更容易得肠炎的原因。
然而,当研究人员给没有疼痛神经的小鼠植入传递痛感信号的CGRP后,小鼠产生粘液的水平又迅速得到了提高。也就是说,即便没有肠道疼痛神经,仅CGRP本身也能保护小鼠抵御肠炎。
这组对比结果表示,CGRP才是促使肠道分泌保护性粘液的关键。
邱实验室的博士后研究员、本研究的第一作者杨达平(Daping Yang,音译)称:“疼痛是像肠炎这样的慢性肠道炎症的常见症状,但我们的研究显示,急性疼痛本身对肠道也起着直接的保护作用。”
止痛的潜在不利之处
研究团队的实验表明,缺少疼痛受体的小鼠在患肠炎后症状会更严重。
研究者称,鉴于目前的肠炎治疗会经常使用到止痛药,止痛所带来的潜在不利后果也值得我们思考。
邱说:“肠道发炎的主要症状之一就是疼痛,因此人们可能会觉得应该先想法止痛来减轻患者的痛苦。然而,一部分疼痛信号本身却能以神经反射的方式对人体起到直接的保护作用。这就使得疼痛管理变得至关重要,因为你不能为了止痛又对病人造成其他伤害。”
除此之外,研究者还发现,一类抑制CGRP分泌的偏头痛药物会扰乱保护性痛感信号的传递,从而破坏肠道屏障。
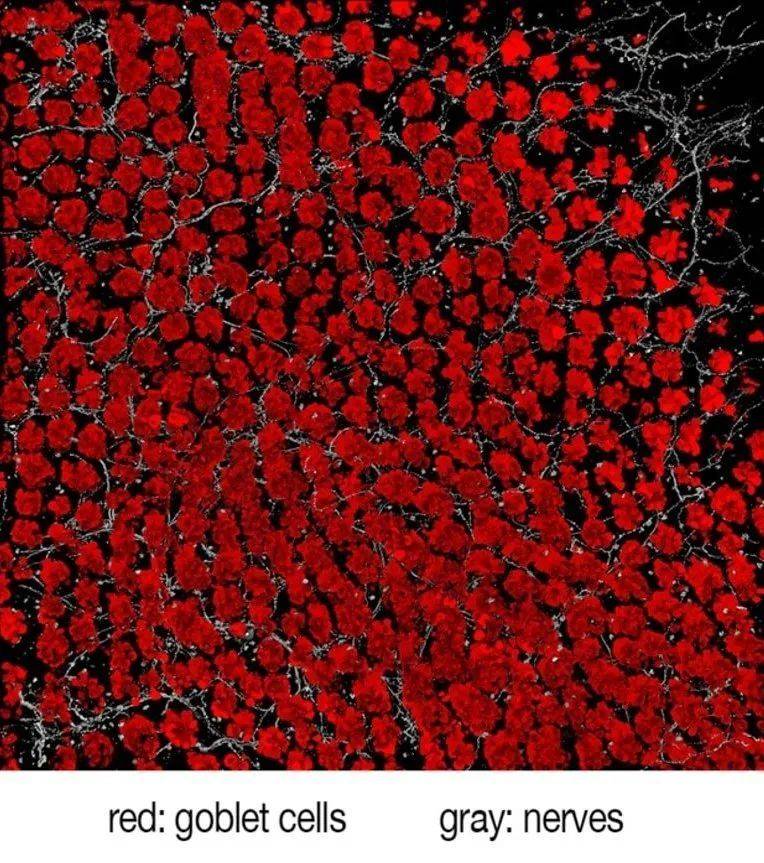
哈佛医学院的研究者们分析了肠道内疼痛神经纤维和肠道内壁上杯状细胞之间的交互关系。研究发现,来自疼痛神经的化学信号会刺激杯状细胞释放保护性粘液来保护肠道免受侵害。这个发现表明,肠道疼痛不仅是一个检测异样和传递信号的系统,还对肠道起着直接的保护作用。—邱实验室/哈佛医学院
邱说:“鉴于CGRP是杯状细胞功能和粘液分泌之间的调节器,如果我们在偏头痛患者身上缓慢地阻断这层保护性机制,或者如果这些病人需要长期服(止痛)药,他们身上又会发生什么呢?药物会扰乱这些人的黏膜衬里(mucosal lining)和微生物群吗?”
杯状细胞在肠道内还有许多其他功能,比如,它们能为抗体提供通道(抗体是在病毒或细菌上发现的可以激发人体免疫反应的蛋白质),还能产生用于抵抗病原体的抗菌化学物质。
杨达平说:“目前的研究还不清楚疼痛神经是否也参与调节了杯状细胞这些方面的功能。”
他补充道,未来的研究还可以进一步探究中断CGRP信号传递路径的后果,以及研究肠道内痛感神经与杯状细胞互动功能失常是否与对炎症性肠病有遗传易感性的患者有关。
译后记
Luvia:这项研究的结果乍看上去还是很反常识的。很多时候,疼痛虽然不等于问题本身,但还是一个需要你咬牙忍耐,然后尽量设法减轻和消除的东西,它的存在更算不上是有益的。但本文却告诉我们:人体通过一个类似于应激反应的逻辑,在面对痛感时其实已经产生了自我保护。这篇文章再一次提醒大家警惕止痛药滥用,因为在人为消除痛感的同时,身体里那层用来自我保护的链接也被悄悄切断了。
来源:https://neurosciencenews.com/pain-gut-mucus-21643/
本文来自微信公众号:神经现实 (ID:neureality),作者:Ekaterina Pesheva,翻译:Luvia