
扫码打开虎嗅APP

本文来自微信公众号:返朴(ID: fanpu2019) ,撰文:史隽,封面:pixabay
2016年8月18日,一位70岁的美国妇女因臀部感染被送入急症室抢救。她的免疫系统为了抵抗感染超负荷运作,导致全身发炎,入院后很快出现感染性休克,病情极度危险。然而,医生们用遍了市面上所有的抗生素,甚至搬出了长年雪藏、不到万不得已绝对不用的粘杆菌素(Colistin),也无法杀灭感染她的细菌。最终,医生们眼睁睁地看着这位病人于几天之后死于多器官衰竭和败血性休克。面对细菌的抗药性,人类没能守住最后一道防线。
过去没有抗生素的悲惨年代,离我们并不遥远。将来没有抗生素可用的日子,也已近在眼前。
人类医学史上两个最伟大的发现莫过于抗生素和疫苗了。
抗生素,是一种能够杀死细菌从而减少感染的药物。它的发现和广泛使用帮助了数十亿人活得更长寿、更健康。然而,我们同时也要为这种人为干涉自然规律的行为付出代价:人类越依赖抗生素,使用得越多,就会有更多的细菌对它们产生耐药性。抗生素的过度使用也对身体造成了许多不好的影响。
抗生素耐药性已经成为全世界最紧迫的健康问题之一。当抗生素对某种细菌不再有效时,这些细菌被认为具有对这种抗生素的耐药性。
现在,一些曾经被认为是治疗细菌感染的标准药物的效果变得很差,有时候甚至根本不起作用。可是,过去30年里被批准上市的新抗生素都是1985年以前发现的旧品种的类似物。目前大约有40多个抗生素在临床测试中,其中创新的品种仍然是凤毛麟角。
这就意味着:在不久的将来,人类也许将没有可用的有效的抗生素,更多的人会死于细菌感染。
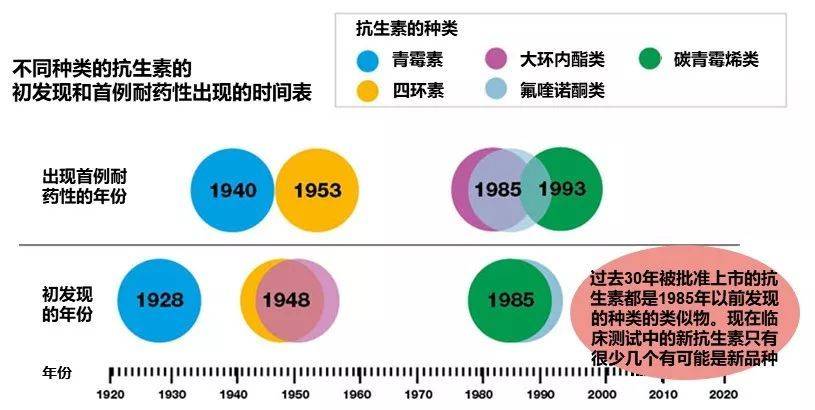
图1:抗生素发现和耐药性产生的时间表 (修改图。原图来自于gov.uk)
抗生素的发现史

在抗生素发现之前,人类没有任何针对肺炎等细菌感染的有效治疗方法。医院里挤满了因割伤或划伤而患上败血症的患者,医生们完全束手无策,只能观察,希望患者能自己熬过去。
1928年,第一个真正的抗生素——青霉素,被英国教授亚历山大·弗莱明(Alexander Fleming)发现。
1928年9月度假回来,弗莱明在伦敦圣玛丽医院的地下室实验室,把有金黄色葡萄球菌的培养皿进行分类。这些细菌会引起皮肤感染、喉咙痛和脓肿,他注意到其中一个培养皿有些不寻常。这个培养皿上遍布细菌菌落,但是在一个角落长了一片霉菌。霉菌周围的区域完全没有任何细菌菌落,就好像霉菌分泌了一些能够抑制细菌生长的“霉菌汁”。
弗莱明发现“霉菌汁”能够杀死各种有害细菌,如链球菌、脑膜炎球菌和白喉杆菌。他和他的助手们试图从“霉菌汁”中分离提纯以后被称为“青霉素”的抗生素,但因为青霉素太不稳定,他们只能拿到很不纯的粗提取物。弗莱明于1929年6月在《英国实验病理学》杂志上发表了他的研究结果,文中仅提及了青霉素的潜在治疗益处。
直到1939年~1944年,科学家们才开始尝试大规模提纯合成青霉素。与此同时,军队和民用领域的临床研究也证实了青霉素的抗菌疗效。20世纪50年代,新抗生素的研发进入了黄金时代,一系列新药被发现并且批准上市。抗生素逐渐在从器官移植到治疗食物中毒等各种疾病中开始发挥必不可少的作用。
然而,所有微生物都会进化从而更适应生存环境。
我们使用抗生素越多,细菌产生耐药性的速度就越快。那些产生抗生素耐药性的细菌会存活下来,而没有耐药性的则会被抗生素杀死。
有抗药性的致命细菌越来越多,现在每年已经造成70万人死亡。美国著名经济学家吉姆·奥尼尔的一份报告预测,如果不采取任何措施,到2050年将有1千万人因为感染了对抗生素有耐药性的细菌而过早死亡[1]。这个问题在包括印度和中国的亚洲,还有非洲尤其严重。
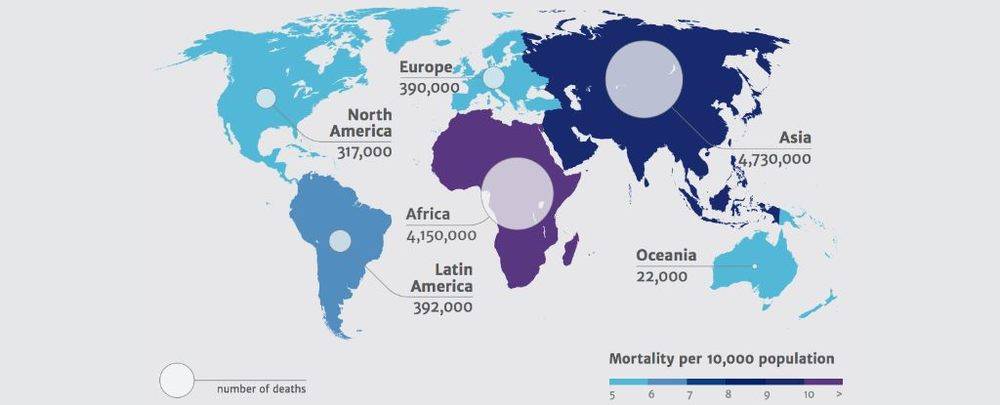
图2:到2050年,各大洲每年因为对抗生素有耐药性的细菌造成的死亡的人数(来自于参考文献[1])
什么原因导致了抗生素耐药性?

当细菌产生一些变化,比如能够保护细菌免受药物的作用或者能够中和药物的时候,细菌就产生了耐药性。这些变化很多是基因突变,能让细菌不被抗生素杀死,更好地存活。
可怕的是,抗生素治疗以后能存活下来的具有耐药性的细菌可以继续繁殖,并且所有的后代都会有抗药性。甚至一些细菌可以将其抗药性转给其他细菌。
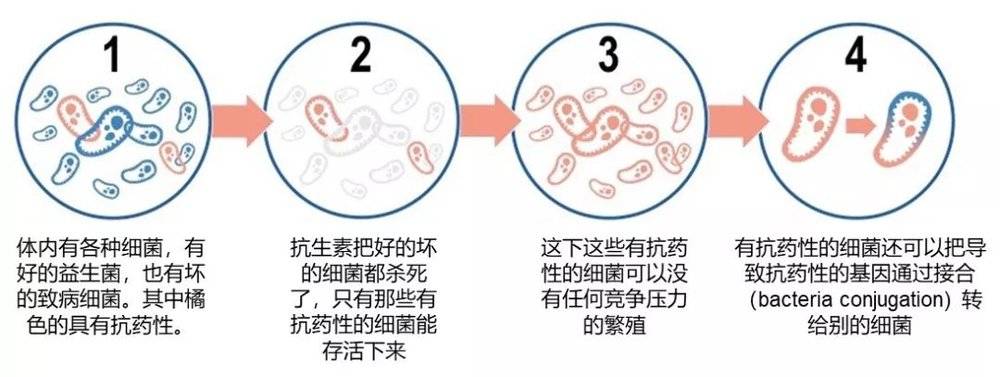
图3:抗生素耐药性是怎么产生和传播的
耐药性的产生是一个正常的物种进化过程。但是,使用药物的方式方法会影响耐药性的发生的速度和程度。
过度使用和滥用抗生素是导致抗生素耐药性的关键因素。
01
抗生素的滥用一方面是人的滥用。
最常见的就是服用抗生素来治疗不是由细菌引起的疾病。根据美国疾病控制和预防中心的数据,高达三分之一到一半的人类抗生素的使用是不必要或不合适的。
抗生素是用来治疗细菌感染的,对病毒感染没有用处。例如,抗生素可以用来治疗因为化脓性链球菌(Streptococcus pyogenes)引起的链球菌性咽喉炎;但对于别的大多数由病毒引起的喉咙痛无效。
其他常见的由于病毒感染引起的,抗生素无效的疾病有:感冒、流感、支气管炎、急性肠胃炎等等。
服用抗生素来治疗病毒感染,非但不能让身体康复,反而可能会造成不必要的有害的副作用。例如抗生素是无选择性地杀体内的细菌,而体内的细菌并不是都是坏的,也有很多对健康有益的“益生菌”。人的胃肠道系统含有约39万亿细菌,大部分存在于大肠中。
过去15年的研究发现,许多这些和人共生的微生物对健康至关重要。它们能够把侵入人体的有害的微生物挤走,将某些人体无法消化的纤维分解成更易吸收的成份,并能产生多种维生素,例如维生素K和B12。过度使用抗生素,会导致肠道微生物环境失调,引起一系列代谢、免疫疾病,甚至影响癌症的治疗[2-8]。
02
另一个更大的问题,也是经常被大众忽视的,是食物里的抗生素。
现在越来越多的牲畜饲养是在拥挤的围栏内(而不是放牧)。在这种拥挤的圈养条件下,一只动物生病,就会很快传染给别的动物。为了预防大面积的传染病的爆发,很多饲养场就给家畜喂食抗生素以促进生长,增加体重以及治疗,控制和预防疾病。
这种日益普遍的做法导致了这些家畜身上剩下的都是抗生素杀不死的细菌。而人类处理食用这些来自家畜的肉类的时候,有抗药性的细菌就会从家畜传染到人。
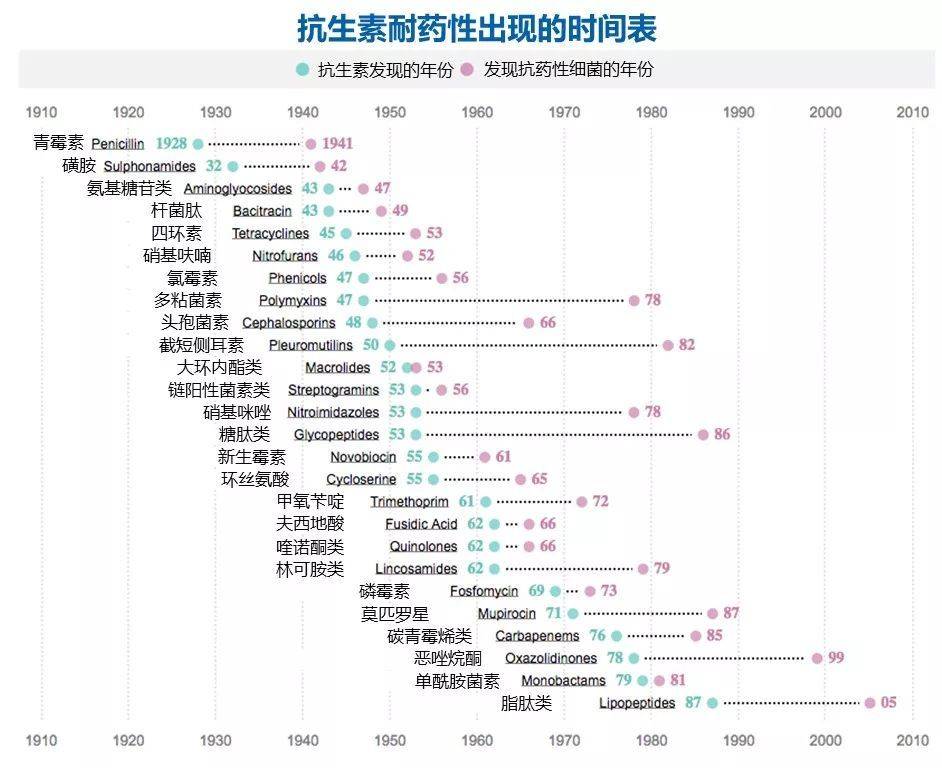
图4:市面上现有的26种抗生素和对应的有抗药性细菌的发现的年份表
新品种抗生素研发的艰难历程

世界上有效的抗生素已经不多了。1940年至1962年间,20多种新型抗生素研发上市。然而,从那以后,只有两个全新的品种进入市场。
10多年前,科学家们开发新的抗生素类似物(新的化合物,但属于已经发现的种类,参见图5)的步伐还勉强能够跟上细菌抗药性产生的速度。现在,已经没有足够的新品种的抗生素或者类似物进入市场来杀死大批产生耐药性的细菌,尤其是革兰氏阴性菌。
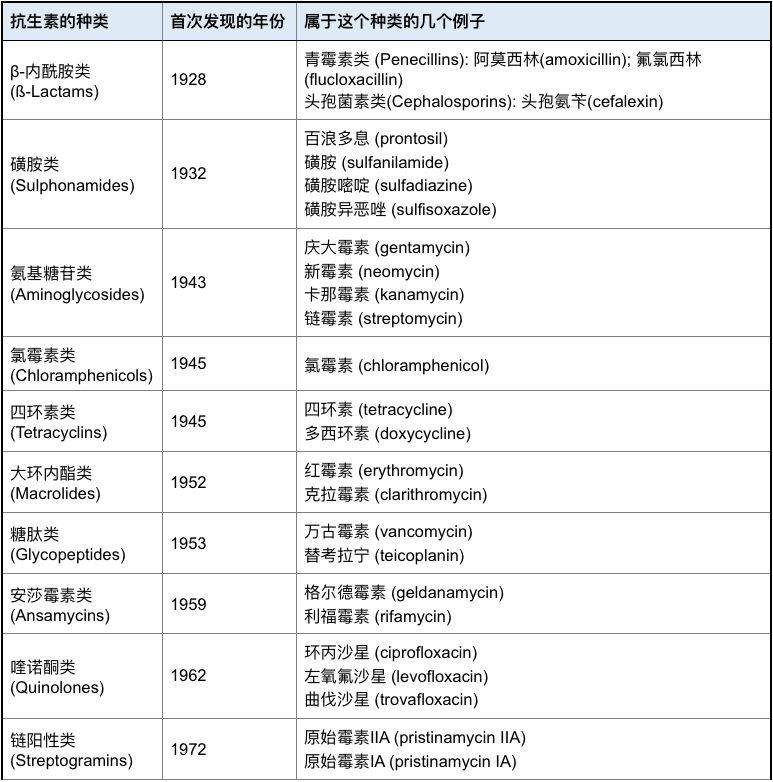
图5:几类有代表性的抗生素
注:我们常用的青霉素类和头孢菌素类抗生素都属于β-内酰胺类,通过抑制细菌细胞壁合成起作用。这两种药物算是广谱的抗生素,对革兰氏阴阳性和厌氧细菌都有效。也正因为这两种抗生素是比较老的药物,抗药性非常普遍。已发现好几种抗药性的机制,其中最常见的是细菌产生了一个酶(β-lactamase, β-内酰胺酶)可以分解这类抗生素。大部分新一代的β-内酰胺类抗生素已经解决了由于β-内酰胺酶引起的抗药性问题。
每一代的青霉素类和头孢菌素类抗生素的药效和副作用都不完全相同。头孢菌素通常被认为是青霉素改进后的新的衍生物,但实际上他们是一种天然物质,并不是在青霉素的基础上改进合成的。生病以后用哪种药物需要根据每个人的情况单独考虑,考虑的因素有很多:感染的类型和严重程度,耐药菌的可能性,患者的健康状况(例如有无别的同时有的疾病,药物过敏史等),药物的副作用,治疗的费用和患者的支付能力,医保政策等等[9]。
科学家正在努力寻找新的突破口,不仅仅是在实验室里开发新的合成物,还试图在以前觉得匪夷所思的各种地方寻找测试新的来源,例如:
1. 科莫多巨蜥可能含有一种能治疗伤口感染的化合物[10]。

图6:科莫多巨蜥 (来自于网络)
2. 亚马逊地区的切叶蚂蚁身上的共生细菌会分泌一些很强效的抗生素[11]。

图7:亚马逊地区的切叶蚂蚁(Tim Flach/Getty Images)
3. 我们脚下的土壤和海底仍然是新抗菌化合物的重要来源[12]。

图8: 土壤和海底
4. 人的鼻子里面发现了一种可以对抗一些超级细菌的抗生素[13]。
5. 英国广播公司新广播大厅门厅的Dalek(著名科幻电视剧Doctor Who中的反派外星人)模型被发现四种潜在的新型抗生素。

图9:查尔斯王子和卡米拉2014年访问英国广播公司时路过Dalek(左边)
在医学如此发达的年代,为什么人类迫切需要的抗生素的研发却如此困难重重?
找到能够杀死细菌的化合物很容易。挑战在于:如果要成为药,这些化合物在能够杀死细菌的有效浓度下,同时还要对人体无害(浓度高了,大部分化合物都对人体有害)。
首先要从基础研究开始,筛选出有可能有抗细菌性质的化合物。这个过程本身可能需要数年时间。
找到候选人以后,先要测试它能够杀死已知的传染性细菌的能力。同时科学家们也会试图研究它工作的机理:有些可能会试图攻击细菌的细胞壁; 有些会干扰细菌的功能或代谢方式。
如果这些结果都还不错,要测试它对人类可能的毒性,并且必须能大规模生产。
最后的最后,还要经过历时多年的临床试验,确认对人体有效并且无大毒性才能被批准上市。这整个过程大约需要10到20年,失败率极高。
这还不是最主要的问题,大多数针对别的疾病的药物研发也要经历类似的过程。
更大的问题还是绕回一个字:钱(研发资金)!
最具创新性的新抗生素不能随便在市面上销售。正因为抗药性是如此普及,最新的抗生素很多时候会被雪藏起来,不到万不得已的时候不去用,免得很快就有细菌对它产生抗药性。
对于投资人来说,这不是一个吸引人的领域,回报率太低,风险太大,成功了还不一定能立刻收益。在过去的30年里,制药公司大大减少了新抗菌疗法的研发。
过去30年被批准上市的所有抗生素都是1984年发现的现有种类的类似物。最令人担忧的是,自从1962年以后,科学家们就没有发现任何新的能够治疗最耐药的革兰氏阴性超级细菌的抗生素。
所有抗生素都杀不死的超级细菌

如果我们不改变使用抗生素的方式,“很快人类将没有任何可用的抗生素”的预言并不是耸人听闻。Doomsday(末日)也许已经开始了。
2016年8月18日,一位美国内华达州的70岁妇女因为右臀部感染引起的全身炎症反应被送到急症。患者很快出现感染性休克,可是感染她的细菌对美国市面上的26种抗生素都有抗药性,甚至包括长年被雪藏、不到万不得已绝对不用的粘杆菌素(Colistin)。因为没有有效的抗生素来杀死感染她的细菌,这位患者最终于九月初去世[14]。
在去世的前两年,这位患者有很长的时间居住在印度。一次意外摔断右腿后,她需要经常去印度医院接受治疗。在这过程中有一种叫肺炎克雷伯菌(Klebsiella pneumoniae)的细菌感染了她的骨骼然后扩散到臀部。
当她回到美国,被送到急症医院的时侯,病情已经非常严重:免疫系统超负荷运作试图抵抗感染,导致全身发炎。因为没有有效的药物,情况加速变化,最终她死于多器官衰竭和败血性休克。
图10:肺炎克雷伯菌(Klebsiella pneumoniae) (来自于sciencemag.org)
以前也有人死于所谓的超级细菌(superbug infection)感染。美国疾病预防控制中心估计,美国每年有23,000人死于对多种抗生素有耐药性的细菌感染。大多数是因为细菌的抗药性发现得太迟了,还没有找到一种有效的抗生素病人就已经去世。而在贫穷国家,主要是因为市面上还没有那些新的、昂贵的抗生素。
然而,美国内华达州的这个病例和以前的都不一样:治疗早期就确认了细菌的抗药性;又是在各种抗生素都可以买到的美国;但即使用了被视为最后一道防线的粘杆菌素也是回天无力。
这也许是一个极端的例子。但有了第一起案例,就会有第二起,第三起。
我们能做的就是在人和动物上都谨慎地使用抗生素,减少细菌菌株产生抗药性的机会,并继续大力投入新抗生素的研发。当新的抗生素出现的时候,也必须有选择地使用,而不是随心所欲地滥用。
抗生素使用的另一个误区

与滥用抗生素相反,很多人为了减少抗生素的使用,避免产生抗药性,会进入另一个误区:一旦情况好转,就立刻停止服用抗生素。这种方式也是不可取的,一旦服用抗生素,就应该坚持完整个疗程,以确保100%杀死引起疾病的细菌。吃吃停停更容易引起复发,并可能促进有害细菌中抗生素抗药性的传播。
抗生素的疗程取决于每个患者的感染类型。大多数抗生素应服用7至14天,但也有情况只需要5天,或者需要28天的。请具体咨询医生来决定最佳治疗时间和正确的抗生素类型。
虽然2017年有一个新的研究,认为坚持完整个疗程才更容易引起抗药性,但这只是一项研究结果,还远不能称为结论。每个人每次患病以后的情况都会不同,感觉好以后多久可以停药还需要进一步的研究。因此目前关于抗生素使用的指导方针还是没有变:确认是细菌感染以后服用抗生素,一旦服用就应该坚持完整个疗程。
制药业和各国政府都应该共同努力,研发新的对抗细菌感染的疗法。
更重要的是,我们都应该尊重并且保护抗生素这个宝贵的资源。抗生素,无论新旧,只有在必要时侯使用才能发挥最大的作用,保护和改善人类健康。
参考文献
1. https://amr-review.org/home.html
2. L. Cuthbertson et al., Respiratory microbiota resistance and resilience to pulmonary exacerbation and subsequent antimicrobial intervention. ISME J 10, 1081-1091 (2016).
3. S. M. Teo et al., The infant nasopharyngeal microbiome impacts severity of lower respiratory infection and risk of asthma development. Cell Host Microbe 17, 704-715 (2015).
4. E. Y. Hsiao et al., Microbiota modulate behavioral and physiological abnormalities associated with neurodevelopmental disorders. Cell 155, 1451-1463 (2013).
5. A. T. Stefka et al., Commensal bacteria protect against food allergen sensitization. Proc Natl Acad Sci U S A 111, 13145-13150 (2014).
6. M. I. Smith et al., Gut microbiomes of Malawian twin pairs discordant for kwashiorkor. Science 339, 548-554 (2013).
7. E. Holmes et al., Human metabolic phenotype diversity and its association with diet and blood pressure. Nature 453, 396-400 (2008).
8. S. Becattini, Y. Taur, E. G. Pamer, Antibiotic-Induced Changes in the Intestinal Microbiota and Disease. Trends Mol Med 22, 458-478 (2016).
9. K. B. Holten, E. M. Onusko, Appropriate prescribing of oral beta-lactam antibiotics. Am Fam Physician 62, 611-620 (2000).
10. E. M.C. Chung, S. N. Dean, C. N. Propst, B. M. Bishop, M. L. van Hoek, Komodo dragon-inspired synthetic peptide DRGN-1 promotes wound-healing of a mixed-biofilm infected wound. npj Biofilms and Microbiomes 3, 9 (2017).
11. T. R. Schultz, Ants, plants and antibiotics. Nature 398, 747-748 (1999).
12. S. I. Maffioli et al., Antibacterial Nucleoside-Analog Inhibitor of Bacterial RNA Polymerase. Cell 169, 1240-1248 e1223 (2017).
13. A. Zipperer et al., Human commensals producing a novel antibiotic impair pathogen colonization. Nature 535, 511-516 (2016).
14. https://www.cdc.gov/mmwr/volumes/66/wr/mm6601a7.htm
《返朴》,致力好科普。国际著名物理学家文小刚与生物学家颜宁联袂担任总编,与几十位学者组成的编委会一起,与你共同求索。