

扫码打开虎嗅APP
作者:菜菜,题图来自:图虫
癌症免疫疗法(简称“免疫疗法”),是一类能利用患者自己的免疫细胞来清除患者体内的癌细胞的癌症疗法。
2011年,CTLA-4免疫检查点抑制剂ipilimumab(Yervoy)获得FDA批准用于治疗晚期黑色素瘤,成为首款获批的免疫疗法。ipilimumab的闪亮登场把这一类新兴抗癌疗法正式推向了公众。
从那时起,又有六种免疫检查点抑制剂和两种CAR-T细胞疗法获得FDA批准,它们或单打独斗,或与其它癌症疗法互相配合,已经延长了许多患者的生命,甚至治愈过一些原本无药可救的晚期癌症患者,是机遇与挑战并存的新兴抗癌利器。
那么,免疫细胞是怎样和癌细胞作战的呢?
1
咱们可以借助小鼠癌症模型和活体荧光成像的技术手段,来看看它们是怎么回事。
这种技术,是给携带荧光标记的小鼠安上一个透明的玻璃视窗,然后透过玻璃视窗,对活的小鼠身上的组织和细胞进行观察。

图1. 小鼠身上得到玻璃视窗(示意)(来自参考文献[1])
2018年Science Immunology的一项研究[2]描述了在小鼠身体里T细胞和淋巴瘤之间的相互影响,提供了比较高清的动图,能看见单个细胞的动作。
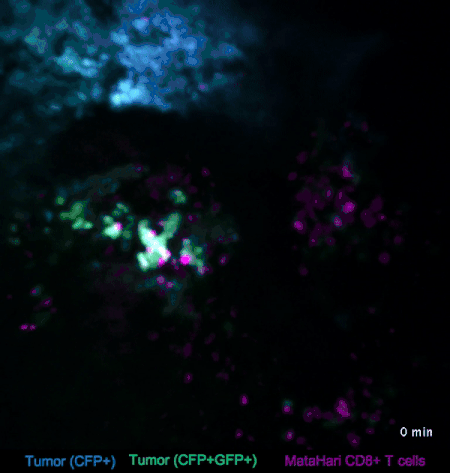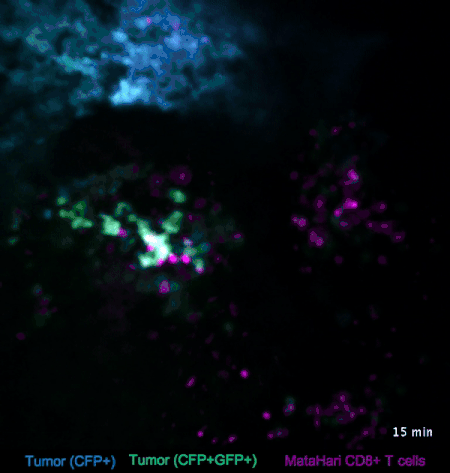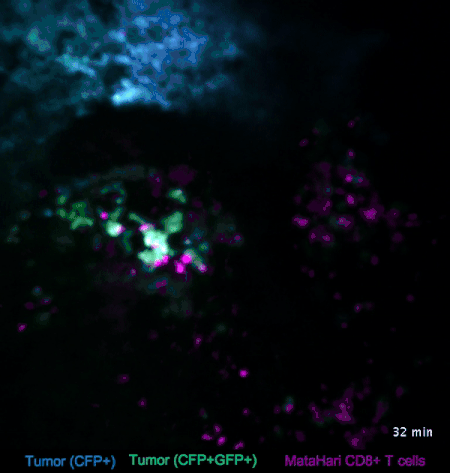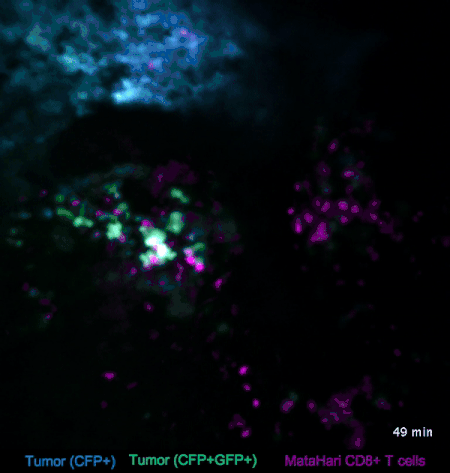
图2. T细胞与淋巴瘤的互动(来自参考文献[2])
比如在图2中,蓝色和绿色的是淋巴瘤的癌细胞,而红色的则是T细胞(一种免疫细胞)。我们可以看到,与癌细胞相比,红色的T细胞就显得相当活跃,时不时地就会去癌细胞那里走一走:蓝色的那坨癌细胞里,来串门子的T细胞比较少,癌细胞也比较致密;而绿色的那坨癌细胞,被走访得比较频繁,也明显比较稀薄。
这是因为,在这个实验里,蓝色和绿色的癌细胞是不同的克隆,在绿色的癌细胞身上,挂着“我是坏人”的标牌——这些标牌非常微小,我们是看不到的,但是红色的T细胞小卫兵们看得到啊,它们在走过去巡视的时候,看见这些标牌,就把“坏人”给干掉啦。
而蓝色的癌细胞呢,没有挂这个牌,也就不怎么招卫兵们上门了。
2
T细胞小卫兵们,又是怎么做的呢?
让我们换一组颜色,移步到图3和图4来,能看得更仔细一点。
在图3和图4里,癌细胞都是白色的。红色和绿色呢,则是两群不同的T细胞:红色的那一群小卫兵,能够识别“坏人”,而绿色的那一群,则识别不了[2]。

图3.图片来自参考文献[2]
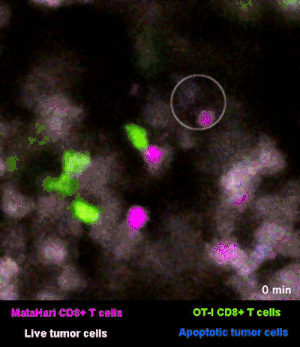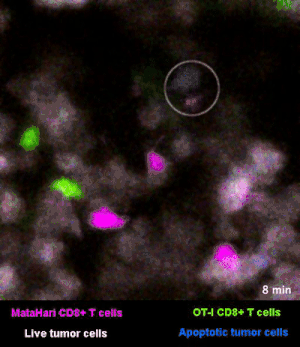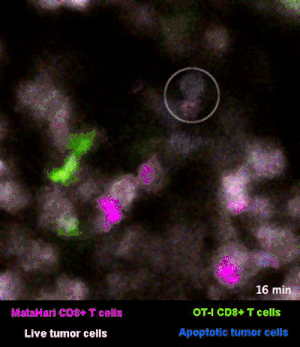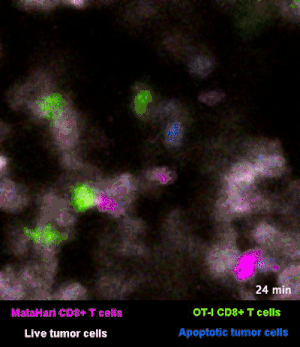
图4. 图片来自参考文献[2]
所以你看那些红的绿的小卫兵们在成团的癌细胞来去穿梭,只有红色的小卫兵能够起到杀伤作用——当红色的T细胞在白色的癌细胞表面停留、一番撕扯之后,白色的癌细胞“坏人”就被干掉了,释放出浅蓝色的死亡信号。
图3里能看到星星点点的蓝色,就是癌细胞正在死亡的标志,在图4的圈圈里,还能看得更仔细一些。
而绿色的T细胞,因为认不出“坏人”呀,就只是徒劳地跑来跑去。
CAR-T细胞疗法呢,就是通过对患者自身的T细胞进行改造,给T细胞小卫兵们装备上“坏人”识别器,再把它们放回体内,它们就能认出“坏人”并且发动攻击了。
图5就是CAR-T细胞在小鼠体内杀灭癌细胞的战况实录了[3]。

图5. 图片来自参考文献[3]
其中,白色的是急性B淋巴细胞白血病(B-ALL)癌细胞“坏人”,绿色的就是经过改造、具备识别“坏人”能力的CAR-T细胞了——这些细胞,就是用来治疗肿瘤、杀灭癌细胞的“药”。
从动图右边的放大部分,可以清楚地看到一个绿色的CAR-T细胞在白色的癌细胞上逗留、撕扯了一会,白色的癌细胞就迅速地释放了蓝色的死亡信号,可谓“药到病除”。而肿瘤小杀手CAR-T细胞,在得手以后,又迅速离开这个被歼灭的“坏人”,奔着下一个“坏人”去了。
T细胞小卫兵们的杀伤力很强吧?
正是因为这些小卫兵们的杀伤力真的很强,在给它们装备“坏人”识别器的时候,必须要非常非常小心,因为癌细胞毕竟是由好细胞变来的,如果识别器不是特别特别精准,T细胞小卫兵们也对着好细胞乱杀一气,杀敌八百自伤三千,那可就麻烦了……
所以,目前CAR-T细胞疗法的应用还是很有限的,局限于部分血液瘤。已经获得FDA批准的两款CAR-T细胞疗法,主要用于治疗儿童急性淋巴细胞白血病和成人的淋巴瘤。
能否把CAR-T细胞疗法的应用拓宽、用来对付实体瘤呢?这就还需要很多很多研究工作了。
3
除了CAR-T细胞疗法以外,另一类主要的免疫疗法,就是免疫检查点抑制剂了,它们主要应用在实体瘤的治疗。现在,免疫检查点抑制剂已经获批用于非小细胞肺癌、肾癌、膀胱癌和三阴性乳腺癌等至少12种实体瘤的治疗。FDA批准的这类药物包括:
三种PD-1抑制剂:pembrolizumab (Keytruda即俗称的K药), nivolumab (Opdivo即俗称的O药) 和cemiplimab (Libtayo);
三种PD-L1抑制剂:atezolizumab (Tecentriq), avelumab (Bavencio) 和durvalumab (Imfinzi);
一种CTLA-4抑制剂,即ipilimumab (Yervoy)。
免疫检查点抑制剂是怎么回事呢?
癌细胞都是由好细胞变来的,是“好人”黑化成的“坏人”,这样的情节就像电视剧一样,随时都在上演。其实有很多的“坏人”,都被T细胞小卫兵们检测到、消灭掉了,并不会对身体造成巨大的健康威胁。
但是,有那么一小撮“坏人”,它们会给自己挂上一套豁免令。这套豁免令就像古装剧里的虎符那样,癌细胞手里拿着一半(比如PD-L1这个分子),T细胞手里拿着另外一半(比如PD-1这个分子)。
电视剧里不是经常有这种镜头吗?类似的情节,可是每天都在细胞之间上演呢。
当T细胞小卫兵遇上癌细胞,两下一照面,“哎?你看起来像是个坏人啊!”但是两边的“虎符”豁免令一碰,PD-1和PD-L1对上了,好,就算你再像坏人,我也不能动手了,告辞告辞。
这套豁免令,就叫做“免疫检查点”。
免疫检查点抑制剂,就是把这套“虎符”给蒙起来,让你们两边对不上,对不上了,还豁免什么呀?T细胞小卫兵们,上来消灭坏人喽。
以PD-1抑制剂为例。
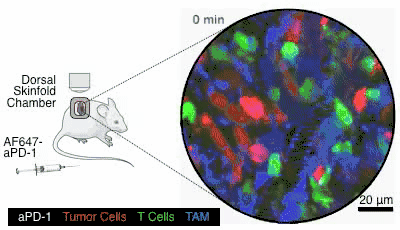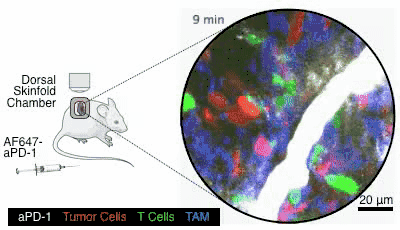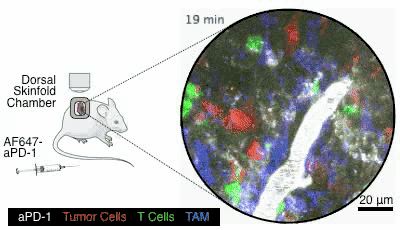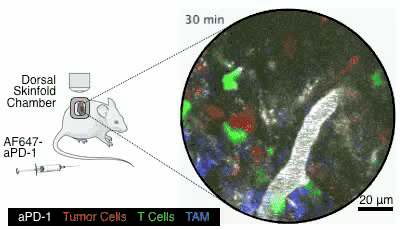
图6. 图片来自参考文献[4]
这个药是通过静脉注射给药的,就像图6,通过小白鼠身上的观察镜,可以看到在小白鼠接受了静脉注射以后,白色的PD-1抑制剂顺着血管奔流而下,四处扩散,就会被绿色的T细胞给接收到(在这个动图里,红色的是癌细胞,蓝色的是其它细胞,图片出自参考文献[4])。
收到药以后,T细胞的行为就会改变了。如图7所示:

图7. 图片来自参考文献[5]
- 在这个动图里,绿色的是T细胞,红色的是携带“坏人”信号的靶细胞(注:靶细胞并不是癌细胞,不过与癌细胞相似地携带了会被T细胞识别并攻击的信号);
- 左边是没有收到药的情况:就算我们知道红色细胞携带了“坏人”信号,T细胞小卫兵们也并不攻击它,只是打了个照面,就让它轻轻松松地过去了;
- 右边是收到药的情况:这下,T细胞可就逮住了靶细胞不放啦。
所以呢,免疫检查点抑制剂,一般适用于本身有免疫T细胞渗透的实体瘤,通过激活那些原本存在的、因为被“豁免令”蒙蔽了而没在干活的T细胞小卫兵,让它们去杀灭癌细胞。
比如,这类药物中第一个获批的ipilimumab,在晚期黑色素瘤中收到了相当不错的疗效,就是因为黑色素瘤内部的T细胞比较多——当年Jim Allison(2018年诺贝尔生理学或医学奖得主)选择了这种有充分免疫渗透、自带T细胞小卫兵的恶性肿瘤开始首个临床试验,在临床医生们的配合下旗开得胜,为此后轰轰烈烈的免疫疗法揭开了大幕,真是个非常聪明和睿智的选择呀。
4
有时候,免疫检查点抑制剂会和化疗药物联合使用。
化疗药物在杀伤癌细胞的同时,能向T细胞小卫兵们更多地暴露癌细胞的“坏人”属性,能把更多的小卫兵引领到癌细胞这里来撕“坏人”,而免疫检查点抑制剂则会让小卫兵们忘记豁免令、大开杀戒——还记得图2里那坨我自巍然不动的蓝色癌细胞团、和稀稀拉拉的绿色癌细胞团吗?化疗药物加上免疫检查点抑制剂,就有可能帮忙把蓝色癌细胞团也变成绿色那样哦。
但是,也有一些肿瘤,并不具备很好的免疫渗透,没有自带T细胞小卫兵,这要怎么办呢?免疫检查点抑制剂能不能派上用场?有很多人正在如火如荼地展开各种相关的研究,让我们拭目以待吧。
另外,目前获得FDA批准的免疫疗法,都是利用T细胞来对癌细胞发动攻击,所以你在这些图里看到的,都是T细胞小卫兵。
而人体的免疫系统,实在是博大精深,除了T细胞以外,还有其它种类的免疫细胞具有潜在的攻击能力,比如NK细胞、巨噬细胞等等,也都有很多人在研究利用它们来对付癌症——能用吗?好用吗?怎么用?
参考文献:
[1] Steenbeek, S. C. et al. Cancer cells copy migratory behavior and exchange signaling networks via extracellular vesicles. Embo j 37, doi:10.15252/embj.201798357 (2018).
[2] Milo, I. et al. The immune system profoundly restricts intratumor genetic heterogeneity. Science immunology 3, doi:10.1126/sciimmunol.aat1435 (2018).
[3] Cazaux, M. et al. Single-cell imaging of CAR T cell activity in vivo reveals extensive functional and anatomical heterogeneity. J Exp Med 216, 1038-1049, doi:10.1084/jem.20182375 (2019).
[4] Arlauckas, S. P. et al. In vivo imaging reveals a tumor-associated macrophage-mediated resistance pathway in anti-PD-1 therapy. Science translational medicine 9, doi:10.1126/scitranslmed.aal3604 (2017).
[5] Michonneau, D. et al. The PD-1 Axis Enforces an Anatomical Segregation of CTL Activity that Creates Tumor Niches after Allogeneic Hematopoietic Stem Cell Transplantation. Immunity 44, 143-154, doi:10.1016/j.immuni.2015.12.008 (2016).
作者:菜菜
