

扫码打开虎嗅APP
本文来自微信公众号:nextquestion(ID:gh_2414d982daee),编译:顾海成,编辑:Jiahui,Lixia,EY,原文标题:《数感是人类独有的能力吗?它和智能的演化有怎样的关系?》,题图来自:视觉中国
数字在我们日常生活的作用举足轻重:我们可以使用数字来标记、排序和量化几乎所有可以想象到的事物。使用以阿拉伯数字为代表的符号化数字表征被认为是人类独一无二的文化成就,其促成了精密科学的发展并塑造了我们当今的世界。因此,长期以来,算术也一直被认为是人类独有的能力。
然而,在过去的几十年中,众多研究聚焦于原始文明、婴幼儿甚至动物的基本数字能力,发现这其实并非是一个语言学或者教育学命题,而是一个生物学命题。发展心理学家的研究已经表明,哪怕是只有几个月大的婴儿,也有能力表征基数词。五个月大的婴儿甚至展示出了对少量对象进行基本加减法运算的能力。
比较心理学也在相关领域取得了突破。研究表明,动物可以区分数字(如集合的基数、集合间大小),并利用数字信息来做出颇为明智的决定。德国蒂宾根大学动物生理学教授安德烈亚斯·尼德(Andreas Nieder)的研究更是进一步指出,整个动物界对于“数字”有着共同的直觉理解。
系统发育不同的大脑产生的数字感
动物界中生物种类繁多,习性也各不相同,然而在对于数字的直觉上却有着惊人的相似。除多孔动物门外,地球上大多数现生的动物都属于两侧对称动物,由共同祖先演化而来。无论是属于鱼类、鸟类或哺乳类等脊椎动物,还是属于昆虫纲、蛛形纲或头足纲的无脊椎动物,都具有区分数量的能力。值得一提的是,这里所说的“数量”对应于集合中元素的个数,是具有离散性的(与之相对应的是类似面积之类的“量”,显然面积是具有连续性的,这里主要考虑动物脑部对于离散数量的处理)。
动物对于数量有一种天生的直觉,或可称之为“数字感”。这种数字感为各种动物种群提供了生存和繁殖的优势,这可以很轻易在对演化史追溯的过程中得到印证。数亿年来,不同物种平行演化,这也导致物种亲缘关系越远,其大脑的复杂性、工作机制和组织结构的差异也越大。但值得玩味的是,这些在结构和机能上都大相径庭的大脑在数字感方面却存在着广泛的相似性。那么,这种相似性又是从何而来的呢?
一种显而易见的解释是,脊椎动物,甚至可以更进一步推断,两侧对称动物的最后一个共同的祖先,其大脑中已经存在了产生数字感的结构。如果上述猜测是成立的,那么可以预想到,如今所有两侧对称动物都保有相同的与数字能力相关的大脑结构。倘如是,动物的数字能力将是一种同源特征,可以追溯到数亿年前的基础动物类群的最后一个共同祖先。
当然,相对应地,我们还可以给出另一种解释,即数字感可能在几个谱系中独立演化,导致动物具有共通数字感的本质原因在于趋同进化而非共同祖先。不同动物种群在生存斗争中面临的压力是类似的。类似的选择压力下,支持动物数字能力的大脑在结构和功能上也会变得较为相近。例如,选择两种不同数量的食物中较大的一种可以确保更多的能量摄入,在种内及种间斗争中数量优势也在很大程度上决定了最终的结果。如果不同的动物皆可以从数字能力中获益,那么赋予它们数字感的独立的大脑变化就会出现,并在种群中得以维持。
针对非人类动物的相关研究的主要难点在于,动物的数字认知研究在测试程序、刺激和数字表征的复杂性方面存在很大差异,因而在评估数字能力的时候需要将其考虑在内。对于在野外生活的动物而言,主要对目标动物进行自主选择测试。测试中,受试动物根据喜好自发地在两种选项(例如,数量不同的食物)之间进行选择。受试动物对于一种选择相对于另一种选择的系统偏好表明其对于不同数量是可以区分的。由于选项需要与目标动物具有内在的相关性,因此其中数量难免与连续量混淆(譬如很难确定动物选择时是出于食物数量的多寡,抑或是食物所占空间的大小)。
此外,在野生环境中,动物的动机状态(即它们是否想在数量之间进行选择)通常是未知的。因而这些研究也只能探讨简单的数字能力,例如观察动物是否能对物体的相对数量做出诸如“大于”或“小于”的决策。因此,自发选择测试仅能提供动物数字能力的提示性而非决定性的证据。需要指出,对非数值连续量的控制是数值认知相关研究中的一个著名的难题。如果没有进行人为控制,非数值连续量也会随着数量的变化而发生改变,而动物也可能会因为这些因素的改变而做出反应。例如四个香蕉所占据的视觉区域显然大于两个香蕉,而动物极有可能会因为黄色区域面积的变化而非香蕉数量的改变而做出反应。
但如果可以在受控环境中观察训练动物,就可以绕过上述这些问题。在这里,可以选取有动机的动物来测试其表现,并使用精心设计刺激来控制非数字因素。训练研究还可以测试更高级的数字能力,例如基于规则精确地比较和处理数字。更重要的是,这些研究都可以与脑研究相结合。
而对于数字抽象意义的理解能力,则主要体现在受试动物跨时间(即一个接一个依次展示的物体)、跨空间(即以阵列形式展示的物体)和感官模式(如分别由视觉和听觉感知到的物体)表征数字的能力。由于方法上的限制,无法在单独的测试中满足所有上述要求。然而,几项控制多种刺激组合的研究清楚地表明,至少一些动物物种,最显著的是猴子和乌鸦,它们都能以灵活的方式区分特定的数字,无论时空和感官模式发生了怎样的变化。这种灵活性尚未在鱼类或蜜蜂身上得到证实,它们通常可以在训练之后根据设定好的规则将一个特定的数字与其他数字或不同的数字区分开来。
一般而言,独立演化的过程中,在性状发生改变之前,往往会利用物种原有的有利性状实现某些其他功能。这也适用于大脑,其特定区域在精细认知功能的发展和支持方面比其他区域更具可塑性。在最近发表在《认知科学趋势》期刊上的一篇文献综述中,安德烈亚斯·尼德从比较生物学和演化生物学的视角,探索了不同脊椎动物大脑产生数字能力的解剖结构和生理学基础。作者指出,脊椎动物的端脑皮层各部分的解剖学和生理学特性非常适合独立产生数字感,而这在脊椎动物的最后一个共同祖先中尚不存在。目前还缺乏更远亲无脊椎动物的神经数据,但可以确定节肢动物和头足类动物存在某些高级的大脑区域与数字能力相关,可以在未来的研究中加以重点关注。
脊椎动物端脑外层产生的数字感

▷ 图1. 脊椎动物用于表征数字的大脑皮层区域的趋异进化(Nieder, 2021)
底图:五个脑泡早期胚胎形成时的侧视图(左图),端脑(两个半球)位于前极。穿过端脑的冠状断面(在虚线的位置)显示了端脑的胚胎布局,代表了假定的脊椎动物祖先的状况,四个脑皮层区域构成了端脑的顶部。
中图(从左到右):鱼、鸦和猴脑的冠状断面,给出了三类脊椎动物表征数字的大脑皮层区域。虽然其中有关鱼的结论是推测性的,但是可以确定由腹侧皮层分化出了NCL(nidopallium caudolaterale)脑区与乌鸦的数字表征有关,而从背侧皮层分化而来的大脑皮层与猴子(以及一般哺乳动物)的数字表征有关。
顶图(从左到右):斑马鱼(代表鱼类),乌鸦(代表鸟类),恒河猴、猫和人类(代表哺乳动物)的大脑的侧视图。红点所示的位置给出了相应物种的大脑用于表征数字的关键区域。
缩写含义:Cb,小脑;OT,视顶盖;Tel,端脑。
1.鱼类
水生脊椎动物的大多数都属于无颌总纲圆口纲(盲鳗、七鳃鳗)、软骨鱼纲(鲨鱼、鳐鱼)或硬骨鱼纲(腔棘鱼、肺鱼和辐鳍鱼)。其中辐鳍鱼占现代鱼类的90%以上。现有有关鱼类的研究指出,一些鱼类在视觉领域拥有基本的数字技能,但这些研究主要关注硬骨鱼类。相比之下,圆口类和软骨鱼的数据较为缺乏。例如某些研究指出,在替代选择任务中,当呈现两种数量的享乐刺激(例如,食物)时,鱼懂得选择更大数量的一组。
最近的研究探索了鱼类数字表征与神经系统的相关性,这些研究涉及鱼类端脑的大脑皮层。如图1所示,鱼类的大脑皮层在大小和分化方面都相对欠发达。对硬骨鱼而言,其大脑皮层通常可以细分为五个部分:内侧、背侧、中部、外侧和后侧。尽管鱼类的大脑结构相对简单,但其大脑皮层的细分及其与其他脊椎动物种群的同源性至今仍然存在争议,特别是考虑到硬骨鱼的端脑通过独特的向外折叠过程发育,而这与其他动物形成了鲜明的差异。
最近通过组织学方法在斑马鱼(一种原生于喜马拉雅地区的热带淡水鱼,属辐鳍鱼纲鲤形目鲤科)大脑皮层中发现了对数字有特定反应的神经元。这些鱼以被动习惯化–去习惯化实验法进行了行为测试,研究着给出的视觉刺激为包含不同个数点的阵列。建立上述范式的基础是,在重复呈现相同刺激后导致的响应该刺激的特定神经元活动的减少(习惯化)。而在这之后,突然切换到新的刺激将会使神经元对新刺激的敏感(去习惯化)。
因此,例如在适应阶段,鱼将重复呈现具有三个点的阵列(控制连续的物理变量);一段时间后,鱼会在驯化阶段突然受到九个点阵列的刺激。去习惯化阶段的数量变化可能与神经元激活的变化有关,这种变化通过在动物死后利用即早基因(IEG,一组在受到一系列外界刺激后迅速并且短暂激活的基因)的表达作为活性标记便可以确认。作为一个关键发现,鱼的大脑皮层(和丘脑)中的IEG表达随着刺激数量的变化而增加。鱼类对于形状和面积的选择行为基本上不存在,这表明活性的变化与数量的变化颇为相关对应于斑马鱼大脑皮层的中部(图 1)。由于大脑皮层的不同衍生物也涉及鸟类和哺乳动物的数字表征,上述发现表明端脑的特性促使动物产生数字感。
随着两栖动物(例如蝾螈、青蛙)的出现,早期的四足动物征服了陆地。在在自由选择测试中,两栖动物更倾向于以来连续量做出判断。在对青蛙的观察中,其仅能够对很小的数字表现出偏好,如在1和2当中做出选择时。因此,在缺乏受控刺激训练研究的情况下,连续量测试上的差异很好地解释了两栖动物的偏好行为。有趣的是,构成青蛙大脑感觉过滤并感知声音的不同呼叫间隔数的神经元被描述为其数字神经元的潜在前体。在两栖动物的大脑中是否能够以及如何表征抽象的数值的数量目前尚不清楚,但表明了第一个四足动物的出现时,其数值能力的系统发育并不是连续的。
2.鸟类
尽管3.2亿年前,鸟类与哺乳动物的最后一个共同祖先开始平行、独立地演化,但鸟类与哺乳动物实则同属于最先进的脊椎动物。鸟类对于数值的理解能力已经被研究了近一个世纪。数感已经在系统发育不同的鸟类中得到了证明(至少在视觉领域),例如鸽子、鹦鹉、鸡、和鸣禽,这表明数感广泛存在于现代鸟类之中。在野外,鸟类在繁殖、觅食和社交互动时会用到数字信息。当使用严格控制非数字线索的刺激进行测试时,鸟类的行为辨别精度与灵长类动物的行为鉴别精度相当。
当使用大区间的数字进行测试时,鸟类会显示出具有近似数字系统的特征:当两个数字差异更大时(“数字距离效应”),其识别能力会系统地增强;当数字的量级增大时,其识别能力会相应地削弱(“数字尺度效应”)。此外,数字的主观感觉与客观刺激幅度的对数成正比(Ditz & Nieder, 2016),这种关系称为费希纳定律(Fechner’s law)。
伴随着其所具有的先进的认知技能,鸟类的大脑相对于它们的体型来说更大,并且与同等体积的非灵长类哺乳动物的大脑相比,神经元数量大大增加。
与哺乳动物形成鲜明对比的是,鸟类大脑的演化伴随着腹侧端脑皮层的大规模扩张,后者成为鸟类大脑的主要神经集成中枢。从腹侧大脑皮层分化而成的主要区域中,有一处(nidopallium)在鸟类的演化过程中显得尤为神秘,无法与哺乳动物进行类比(图 1)。在此区域内,有涉及诸多认知功能和多模态处理的高级区域NCL,并已被确定与鸟类的数字表征相关。
在延迟匹配样本测试中,乌鸦要求区分非数字线索控制的视觉项目的数量。在受过训练的乌鸦的NCL中,研究者发现了对特定数字有选择性响应的神经元(“数字神经元”)。在测试中,阵列同时显示和次第显示的点的数量都被编码。神经元的钟形调谐曲线显示了神经元各自首选数量的峰值放电率(图2)。数字神经元的编码特性可以解释为什么乌鸦有时表现对数字不能精确认知(数字距离效应),为什么乌鸦会随着数量级的增加而失去认知的精度(数字尺度效应),以及为什么它会遵循韦伯‑费希纳定律(Weber–Fechner law)显示出对数缩放的性质。
与行为相对应,当乌鸦在任务中犯错时,与其在准确执行时相比,数字神经元的反应更少。即使没有特定的数字训练,NCL中的数字神经元也会在乌鸦大脑自发生成,这一发现表明数字提取的神经元机制是NCL回路所固有的。与位于NCL神经元相反,乌鸦海马体中的神经元对数字没有反应。这表明数字神经元在解剖学上是受限的,并非在鸟类大脑的所有关联区域中都存在。
鸟类是原始爬行动物群的后裔,从系统发育的角度来看,它们是恐龙。因此,鸟类与爬行动物(鳄鱼、乌龟、蜥蜴和蛇)的关系更密切,它们共同构成了“蜥脚类”。相关研究不多,但可以表明,爬行动物主要使用连续量自主地获得对不同集合的偏好。将海龟放到同等大小切片但数量不同的番茄之间,海龟自发地做出有偏好的选择,准确率为69%。但面对所有的设置(如两片与四片,两片与三片,三片与四片),海龟的选择几乎是随机的,准确率在59%以下。即使切片大小相同,陆龟的辨别能力也可能基于与数量共同变化的连续的变量。最近获得的有关爬行动物以及两栖动物的数据表明,四足动物和最有可能的脊椎动物的最后的共同祖先没有数字感。数字感似乎是在硬骨鱼、鸟类和哺乳动物中独立出现的。

▷ 图2. 脊椎动物大脑中的数字选择性神经元
(A)乌鸦的NCL中的神经元数量。所示为偏好相同数量(由相同颜色表示)的神经元归一化调整后的平均值(Ditz & Nieder, 2015)。(B)恒河猴顶内沟中的神经元数量(Niede & Miller, 2004)。(C)对人类内侧颞叶中的神经元数量(Kutter et al., 2018)。
3.哺乳类
与鸟类相比,哺乳动物有从背侧皮层演化而来的六层大脑皮层(新皮质),是哺乳动物中最高的集成中枢。特别是在灵长类动物谱系中,扩大的联想皮层区域——连同感觉输入和运动输出皮层——产生复杂的认知。
在野外和实验室中研究的几种哺乳动物中都发现被测对象对数字的认知。这包括大鼠(啮齿动物)、鲸鱼和海豚(鲸类)、鬣狗(食肉动物)、大象(长鼻动物)(Perdue et al., 2012)和灵长类动物(例如猴子、猿、人类)。与鸟类一样,哺乳动物同样遵循韦伯‑费希纳定律。
对食肉动物、非人类灵长类动物及人类大脑的研究一再表明大脑皮层,特别是顶叶和额叶皮层的数量处理有关(图1)。1970年在麻醉猫身上进行了第一次有关数字表征的神经元相关性的电生理学研究。在被动呈现听觉或视觉刺激序列的过程中,猫后侧关联皮层中的一小部分神经元对特定数量的题目做出反应。最近,功能成像揭示了清醒状态下狗被动观察点阵列时各个皮层区域(包括顶叶区域)神经元不规则地激活。
对于清醒状态下的非人类灵长类动物(特别是猕猴),存在一系列丰富的与数字行为相结合的,有关数字表征的神经数据。视觉题目(或同时按顺序呈现)、多模式视觉‑听觉题目或手部运动中,特定的数字都是导致特定神经的反应,而这些反应皆是从后顶叶和额叶皮层测得的。有的研究甚至发现了动物对空集的响应,这可以视为其表征数字零的前兆。与乌鸦一样,猴子数神经元自发存在,无需在新皮质回路中进行特定训练。研究进一步说明,数字神经元的活动与猴子的数字技能相关。此外,这些数字神经元的调谐特性显示了近似数字系统的特征(图2)。远不只表征数字类别的感知,在工作记忆期间,数字神经元参与处理与概念决策一致的数字信息。
灵长类的新皮质较其他动物更为肥大,而人类的新皮质则在此基础上有了额外的增大。人类特异性基因表达模式在个体发育过程中致使更多神经元的产生,而这也伴随着大脑皮层的各种结构变化,例如顶叶、颞叶和额叶中新皮质相关区域的相对增大。与这些增大相关联的皮质可以实现人类独特的符号能力,包括算术和数学技能。
与之前的发现一致,额叶和后顶叶皮层的病变会使患者数字处理能力受损,许多功能成像研究表明后顶叶和额叶皮层与成人及儿童完成各种非符号和符号运算任务相关。此外,在患者的海马大脑皮层中得到的数量神经元记录,显示出与非人类灵长类动物的大脑皮层及乌鸦NCL相同的特征(图2)。在人类海马体中发现数字神经元也凸显了灵长类动物和鸟类之间在数字处理方面的一个有趣差异,因为鸟类的海马体中并不包含数字神经元。
可能与无脊椎动物数字感相关的神经基础
与脊椎动物相比,迄今为止仍缺乏对无脊椎动物数字感神经基础的研究。尽管众所周知,蜜蜂、蜘蛛和鱿鱼都能够区分不同的集合,但在固定无脊椎动物建立实验法方面的技术困难阻碍了神经科学的探索。本节确定了昆虫、蛛形纲和头足纲动物脑中有可能与数字表征有关的候选区域,以期对未来的神经科学探索提供帮助。
1.昆虫和蜘蛛
现存节肢动物(包括昆虫和蜘蛛)估计有700万种(相比之下脊椎动物大约只有7万种[IUCN, 2021]),是迄今地球上最大且最多样化的动物门类。使用期望‑违背实验法,一种捕食蜘蛛的蜘蛛(Portia Africana)仅可以表征追逐开始和结束时观察到的猎物数量。当发现数字不匹配时,蜘蛛在追逐后便更不愿意再靠近。即使控制了猎物的大小和排列,这种反应也会保持。因此,这表明蜘蛛可以表征少量的数字来指导其行为。
而有关昆虫的报告则给出了更多关于数字表征的直接证据。基于训练蜜蜂区分地标而开展的几项对照研究或控制阵列中的视觉元素的数量的研究,揭示了蜜蜂近似数字系统的工作原理,其数字距离效应和数字尺度效应类似于脊椎动物。蜜蜂甚至可以根据规则对数字进行排序,并理解空集代表的数量比1小。
节肢动物的中枢神经系统包括带有连接神经节的腹神经索和头部的中央区域,围绕前消化道形成“咽下区”和“咽上区”。在蜘蛛中,头部中心化更加明显,形成所谓的“神经节”。食道上区被认为是节肢动物的大脑。它包括(从前到后)前脑、中脑和后脑。
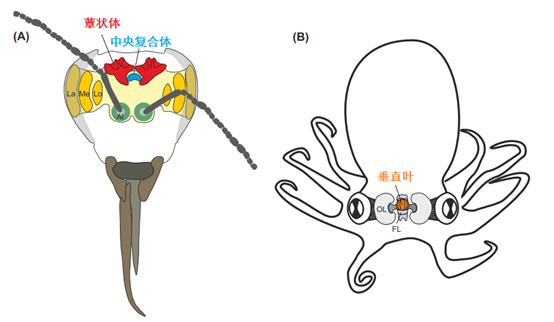
▷ 图3. 节肢动物和软体动物大脑中与数字表征有关的候选结构
(A)蜜蜂大脑示意图。视神经叶(VL)包括薄板(La)、髓质(Me)和小叶(Lo),并接收来自复眼的视觉输入。触角神经叶(AL)接收来自触角嗅觉神经元的输入。蕈状体和中央复合体处理多模态信息并参与学习和记忆。(B)头足类动物(章鱼)神经系统解剖结构。咽上和咽下脑团块构成大脑(彩色),两个大视叶(OL)位于其两侧。缩写:FL,额叶。
表征数字信息的神经元可能存在于昆虫和蜘蛛大脑中的什么位置?节肢动物有一个明显的整合中心,横跨前脑的中线。此结构即昆虫的“中央复合体”,对应蜘蛛的“弓形体”(图3)。尽管存在重大差异,但这两种结构可能源自节肢动物的共同祖先的中线结构,并在节肢动物大脑中充当高等的关联结构。这些区域的神经元接收高度处理的视觉输入,特别是在蜘蛛中,进而参与视觉对象识别和视觉记忆,因此可以表征数量的类别。
蜘蛛的神经元记录显示,弓形体处理多模态信息,同时对高级视觉、听觉和触觉信息做出反应。在昆虫中,中央复合体构成感觉运动中枢,并在定向和导航、行为选择和运动协调中发挥作用。中央复合体在运动时间结构中的作用有可能是对连续呈现的物体的数量进行编码,其运动功能还可以支持特定数量的运动。
昆虫和蜘蛛最有可能用来表征抽象和跨模态数的脑区是前脑中的双侧蕈状体(图 3A)。尽管蜘蛛的对应部位尚未被充分研究,基于昆虫的研究证明其蕈状体整合了高度处理的多模态信息,并构成了标志性的联想学习和记忆中心。受昆虫启发而建立的神经网络模型表明,可以在中央复合体或蕈状体中实现循环短期记忆回路,以作为昆虫中顺序呈现元素的计数器。根据记忆表达模式和回路的模体,研究人员对节肢动物蕈状体的结构和功能与哺乳动物大脑皮层进行了比较,比较的部位包括海马、杏仁核和前额叶皮层。有趣的是,所有这些外套区都与人类的数字处理有关。总之,蕈状体是节肢动物控制抽象数字和跨模态表征的理想候选区域。
2.软体动物
头足纲动物,如章鱼、墨鱼和鱿鱼是具有大型脑部的软体动物。一些研究表明,它们表现出有趣的认知属性,例如精细的感知、熟练的运动能力以及学习和记忆。一项研究测试了头足类动物对数量的偏好。令乌贼幼鱼在1到5只活虾之间选择,它们毫不意外地表现出对较大数量的偏好。对训练有素的头足类动物以及给出更可控的刺激进行研究,将有助于更好地揭示它们的数字运算能力,并将它们对连续数量的偏好进行对比。
与所有其他动物(包括节肢动物)相比,头足类的中枢神经系统在基因表达、脑网络组织和总体解剖学方面是最独特的。其中枢神经系统分为三个部分(图3):一个中枢脑叶系统(大脑),包含数十个脑叶,包括围绕食道的咽上和咽下脑团块;直接从眼睛的光受体接收视觉信息的成对大视叶;臂中的大量神经节和神经索可以独立控制每条臂。它们的神经元数量异常高。例如,普通章鱼在中枢脑叶系统中拥有大约4000万个神经元,在视叶中拥有1.3亿个神经元,在臂外围中心拥有大约3亿个神经元。
在头足类动物大脑的许多脑叶中,垂直叶被认为是最高的整合中心(图3)。垂直叶似乎不直接参与运动或感觉功能。相反,垂直叶的病变会导致其与猎物捕获和导航相关的联想学习和长期记忆缺陷。因此,垂直叶被认为具有类似于昆虫蕈状体和哺乳动物海马记忆系统的功能,尽管与这些结构相比,它的谱系和大脑回路有很大不同。由于其综合性和学习相关的作用,垂直叶是头足类动物研究数值表征的主要候选区域。
结语
在迄今为止研究的所有脊椎动物中,端脑皮层皆是与数字表征相关的关键区域。鱼类大脑皮层中的神经元发出数字变化的信号,而大规模增大和独立演化的鸟类的大脑皮层和哺乳动物的大脑皮层(“新皮层”)也明确与表征数字有关。
尽管数字的表征会用到端脑的大脑皮层,但这并不一定意味着脊椎动物(甚至蜥龙类)的最后一个共同祖先具有作为遗传特征的数字感。相反,由于硬骨鱼类、鸟类和哺乳类动物在系统发育过程中独立且趋同地增加了各自大脑的相对大小,因此它们很可能也经历了多种行为特征的趋同进化。这种趋同进化轨迹可以在许多层面上被观察到。对于数字表征来说,情况可能也是如此。
对不同种群动物大脑皮层差异的细致研究证实了独立演化的观点。研究人员已经研究了不同动物大脑皮层的同源分区,例如爬行动物和哺乳动物的背侧大脑皮层,两个种群之间的一对一同源性(在基因表达层面)对于特定的细胞而言并不存在。除了这些差异之外,不同的大脑皮层区域——哺乳动物的背侧大脑皮层(新皮质)和鸟类的腹侧大脑皮层——却有着相同的功能(例如,数字处理、工作记忆,以及其他认知功能)。有趣的是,鸟类大脑皮层的感官不是依赖于NCL等更高级别的关联区域,而是显示出类似皮层的组织,具有迭代重复的经典回路,以及堆叠排列的水平神经层和与之正交的垂直列。然而,鸟类的这些回路(源于腹侧大脑皮层)似乎涉及完全不同类别的兴奋性和抑制性大脑皮层神经元,而哺乳动物新皮层(源于背侧大脑皮层)中没有对应物(Colquitt et al., 2021)。这些发现可以认定鸟类和哺乳类动物大脑相关部位的独特起源是二者趋同进化的明确标志。
无论哪个区域最终演化为最高的整合中心(如鸟类的腹侧皮层与哺乳动物的背侧皮层),某些有关脑回路的特性将会与抽象类别和概念的表征有关。大脑皮层的优势之一是它可以作为(丘脑)感觉输入和(意志)运动输出之间的中介。这使其能够以明确和目标导向的方式响应感知到的数字信息,并允许跨感官模式合成信息。因为数字是超出特定模态的抽象类别(三段声音和三张图片都对应数字3),所以数字表征依赖于这种感觉的合并,这在关联的大脑区域中找到。
大脑皮层的回路支持循环处理(分层处理级别之间的前馈和反馈投影级联),其中信息重新进入先前处理单元以施加自上而下的影响,并且可以在关联网络中保持活跃。认知功能——数字处理是其中的一个实例——依赖于通过交互和重入式连接对信息的时间进行缓冲。尽管是独立演化,但鸟类和哺乳类动物的大脑皮层连接组非常相似。这可能会实现数字表征和其他认知功能所需的等效处理动态。基于遗传的细胞类型识别以及基于微回路分析的广泛比较,将有助于我们理解动物大脑的结构和功能属性,这些属性似乎使大脑皮层在趋同进化中成为表征数字的理想候选区域。
与脊椎动物相比,迄今为止,仍缺乏对无脊椎动物数字感神经基础的研究。通过分析和综合目前关于无脊椎动物大脑在分子、结构和生理层面的知识,可以确定昆虫纲、蜘蛛刚和头足纲动物的大脑中与数字表征相关的候选区域,可用于未来的神经科学探索。由于头足纲动物的生理学研究在方法论层面上受到了不小的挑战,而昆虫——尤其是蜜蜂——可能是最有希望的突破口之一。将为研究蝇类而建立的从遗传到成像的方法移植到对蜜蜂的研究可能会开辟一条新的研究途径。当然,这种做法是具有挑战性的,但这也许会揭示数字感的神经学结构在更根本的层次上具有相似性。
编译来源:https://www.cell.com/trends/cognitive-sciences/fulltext/S1364-6613(21)00087-5
参考文献
Abramson, J.Z. et al. (2013). Relative quantity judgments in the beluga whale (Delphinapterus leucas) and the bottlenose dolphin (Tursiops truncatus). Behav. Process. 96, 11–19.
Agrillo, C. et al. (2010). Large number discrimination by mosquitofish. PLoS One 5, e15232.
Agrillo, C. et al. (2014). Numerical acuity of fish is improved in the presence of moving targets, but only in the subitizing range. Anim. Cogn. 17, 307–316.
Albertin, C. et al. (2015). The octopus genome and the evolution of cephalopod neural and morphological novelties. Nature 524, 220–224.
Anobile, G. et al. (2021). A sensorimotor numerosity system. Trends Cogn. Sci. 25, 24–36.
Arsalidou, M. and Taylor, M.J. (2011). Is 2+2=4? Meta-analyses of brain areas needed for numbers and calculations. Neuroimage 54, 2382–2393.
Arsalidou, M. et al. (2018). Brain areas associated with numbers and calculations in children: meta-analyses of fMRI studies. Dev. Cogn. Neurosci. 30, 239–250.
Ashkenazi, S. et al. (2008). Basic numerical processing in left intraparietal sulcus (IPS) acalculia. Cortex 44, 439–448.
Aulet, L.S. et al. (2019). Canine sense of quantity: evidence for numerical ratio-dependent activation in parietotemporal cortex. Biol. Lett. 15, 20190666.
Benson-Amram, S. et al. (2011). Numerical assessment and individual call discrimination by wild spotted hyaenas, Crocuta. Anim. Behav. 82, 743–752.
Benson-Amram, S. et al. (2017). Numerical assessment in the wild: insights from social carnivores. Philos. Trans. R. Soc. Lond. B Biol. Sci. 373, 20160508.
Beran, M.J. (2007). Rhesus monkeys (Macaca mulatta) enumerate large and small sequentially presented sets of items using analog numerical representations. J. Exp. Psychol. Anim. Behav. Process. 33, 42–54.
Bongard, S. and Nieder, A. (2010). Basic mathematical rules are encoded by primate prefrontal cortex neurons. Proc. Natl. Acad. Sci. U. S. A. 107, 2277–2282.
Bortot, M. et al. (2019). Honeybees use absolute rather than relative numerosity in number discrimination. Biol. Lett. 15, 20190138.
Brannon EM, Terrace HS. (1998). Ordering of the numerosities 1 to 9 by monkeys. Science 282:746–49.
Brannon, E.M. and Terrace, H.S. (1998). Ordering of the numerosities 1 to 9 by monkeys. Science 282, 746–749.
Briscoe, S.D. and Ragsdale, C.W. (2019). Evolution of the chordate telencephalon. Curr. Biol. 29, R647–R662.
Briscoe, S.D. et al. (2018). Neocortical association cell types in the forebrain of birds and alligators. Curr. Biol. 28, 686–696.e6.
Chittka, L. and Geiger, K. (1995). Can honey bees count landmarks? Anim. Behav. 49, 159–164.
Clayton, N.S. and Emery, N.J. (2015). Avian models for human cognitive neuroscience: a proposal. Neuron 86, 1330–1342.
Cognigni, P. et al. (2018). Do the right thing: neural network mechanisms of memory formation, expression and update in Drosophila. Curr. Opin. Neurobiol. 49, 51–58.
Colquitt, B.M. et al. (2021). Cellular transcriptomics reveals evolutionary identities of songbird vocal circuits. Science 371, eabd9704.
Cross, F.R. and Jackson, R.R. (2017). Representation of different exact numbers of prey by a spider-eating predator. Interface Focus 7, 20160035.
Dacke, M. and Srinivasan, M.V. (2008). Evidence for counting in insects. Anim. Cogn. 11, 683–689.
Davis H, Perusse R. (1988). Numerical competence in animals: definitional issues, current evidence, and a new research agenda. Behav. Brain Sci. 11:561–615.
DeLong, C.M. et al. (2017). Small and large number discrimination in goldfish (Carassius auratus) with extensive training. Behav. Process. 141, 172–183.
Ditz, H.M. and Nieder, A. (2015). Neurons selective to the number of visual items in the corvid songbird endbrain. Proc. Natl. Acad. Sci. U. S. A. 112, 7827–7832.
Ditz, H.M. and Nieder, A. (2016). Numerosity representations in crows obey the Weber–Fechner law. Proc. Biol. Sci. 283,20160083.
Ditz, H.M. and Nieder, A. (2016). Sensory and working memory representations of small and large numerosities in the crow endbrain. J. Neurosci. 36, 12044–12052.
Ditz, H.M. and Nieder, A. (2020). Format-dependent and format-independent representation of sequential and simultaneous numerosity in the crow endbrain. Nat. Commun. 11, 686.
Ditz, H.M. and Nieder, A. (2020). Format-dependent and formatindependent representation of sequential and simultaneous numerosity in the crow endbrain. Nat. Commun. 11, 686.
Ditz, H.M. et al. (2018). Neurons in the hippocampus of crows lack responses to non-spatial abstract categories. Front. Syst. Neurosci. 12, 33.
Eiselt, A.K. and Nieder, A. (2013). Representation of abstract quantitative rules applied to spatial and numerical magnitudes in primate prefrontal cortex. J. Neurosci. 33, 7526–7534.
el Jundi, B. et al. (2015). Neural coding underlying the cue preference for celestial orientation. Proc. Natl. Acad. Sci. U. S. A. 112, 11395–11400.
Eriksson, J. (2015). Neurocognitive architecture of working memory. Neuron 88, 33–46.
Feigenson L, Dehaene S, Spelke E. (2004). Core systems of number. Trends Cogn. Sci. 8:307–14.
Fernandes, D.M. and Church, R.M. (1982). Discrimination of the number of sequential events. Anim. Learn. Behav. 10, 171–176.
Fiore, V.G. et al. (2015). Evolutionarily conserved mechanisms for the selection and maintenance of behavioural activity. Philos. Trans. R. Soc. Lond. B Biol. Sci. 370, 20150053.
Fiorito, G. and Chichery, R. (1995). Lesions of the vertical lobe impair visual discrimination learning by observation in Octopus vulgaris. Neurosci. Lett. 192, 117.
Foelix, R. (2010). Biology of Spiders (3rd edn), Oxford University Press.
Ganz, J. et al. (2014). Subdivisions of the adult zebrafish pallium based on molecular marker analysis. J. Comp. Neurol. 3, 308.
Gazzola, A. et al. (2018). Continuous and discrete quantity discrimination in tortoises. Biol. Lett. 14, 20180649.
Giurfa, M. (2019). An insect’s sense of number. Trends Cogn. Sci. 23, 720–722.
Goldman-Rakic, P.S. (1995). Cellular basis of working memory. Neuron 14, 477–485.
Graindorge, N. et al. (2006). Effects of dorsal and ventral vertical lobe electrolytic lesions on spatial learning and locomotor activity in Sepia officinalis. Behav. Neurosci. 120, 1151–1158.
Güntürkün, O. and Bugnyar, T. (2016). Cognition without cortex. Trends Cogn. Sci. 20, 291–303.
Hauser MD, Carey S, Hauser LB. (2000). Spontaneous number representation in semifree-ranging rhesus monkeys. Proc. R. Soc. Lond. B Biol. Sci. 267:829–33.
Heisenberg, M. (2003). Mushroom body memoir: from maps to models. Nat. Rev. Neurosci. 4, 266–275.
Hochner, B. and Shomrat, T. (2014). The neurophysiological basis of learning and memory in an advanced invertebrate: the octopus. In Cephalopod Cognition (Darmaillacq, A. et al., eds), pp. 72–93, Cambridge University Press.
Homberg, U. (2008). Evolution of the central complex in the arthropod brain with respect to the visual system. Arthropod. Struct. Dev. 37, 347–362.
Honkanen, A. et al. (2019). The insect central complex and the neural basis of navigational strategies. J. Exp. Biol. 222, jeb188854.
Howard, S.R. et al. (2018). Numerical ordering of zero in honey bees. Science 360, 1124–1126.
Howard, S.R. et al. (2019). Surpassing the subitizing threshold: appetitive-aversive conditioning improves discrimination of numerosities in honeybees. J. Exp. Biol. 222, jeb205658.
Hulse, B.K. et al. (2020). A connectome of the Drosophila central complex reveals network motifs suitable for flexible navigation and context-dependent action selection. bioRxiv Published online December 9, 2020. https://doi.org/10.1101/2020.12.08.413955.
Hunt, S. et al. (2008). Adaptive numerical competency in a food-hoarding songbird. Proc. Biol. Sci. 275, 2373–2379.
Ito, K. et al. (2014). A systematic nomenclature for the insect brain. Neuron 81, 755–765.
IUCN (2021). IUCN Red List Version 2020–3. Table 1a. IUCN.
Jacob, F. (1977). Evolution and tinkering. Science 196, 1161–1166.
Jacob, S.N. and Nieder, A. (2014). Complementary roles for primate frontal and parietal cortex in guarding working memory from distractor stimuli. Neuron 83, 226–237.
Jacob, S.N. et al. (2018). Structuring of abstract working memory content by fronto-parietal synchrony in primate cortex. Neuron 99, 588–597.e5.
Jordan, K.E. et al. (2008). Monkeys match and tally quantities across senses. Cognition 108, 617–625.
Kim, G. et al. (2021). Visual number sense in untrained deep neural networks. Sci. Adv. 7, eabd6127.
Kirschhock, M.E. et al. (2021). Behavioral and neuronal representation of numerosity zero in the crow. J. Neurosci. https://doi.org/10.1523/JNEUROSCI.0090-21.2021.
Koehler, O. (1941). Vom Erlernen unbenannter Anzahlen bei Vögeln. Naturwissenschaften 29, 201–218 (in German).
Krusche, P. et al. (2010). Quantity discrimination in salamanders. J. Exp. Biol. 213, 1822–1828.
Kutter, E.F. et al. (2018) Single neurons in the human brain encode numbers. Neuron 100, 753–761 e4.
Kutter, E.F. et al. (2018) Single neurons in the human brain encode numbers. Neuron 100, 753–761 e4.
Leibovich, T. et al. (2017). From “sense of number” to “sense of magnitude”: the role of continuous magnitudes in numerical cognition. Behav. Brain Sci. 40, e164.
Lemer, C. et al. (2003). Approximate quantities and exact number words: dissociable systems. Neuropsychologia 41, 1942–1958.
Liu, G. et al. (2006). Distinct memory traces for two visual features in the Drosophila brain. Nature 439, 551–556.
Llinares-Benadero, C. and Borrell, V. (2019). Deconstructing cortical folding: genetic, cellular and mechanical determinants. Nat. Rev. Neurosci. 20, 161–176.
Martin, J.P. et al. (2015). Central-complex control of movement in the freely walking cockroach. Curr. Biol. 25, 2795–2803.
McComb K, Packer C, Pusey A. (1994). Roaring and numerical assessment in contests between groups of female lions, Panthera leo. Anim. Behav. 47:379–87.
Menda, G. et al. (2014). Visual perception in the brain of a jumping spider. Curr. Biol. 24, 2580–2585.
Menzel, R. (2014). The insect mushroom body, an experiencedependent recording device. J. Physiol. Paris 108, 84–95.
Merten, K. and Nieder, A. (2009). Compressed scaling of abstract numerosity representations in adult humans and monkeys. J. Cogn. Neurosci. 21, 333–346.
Messina, A. et al. (2020). Neurons in the dorso-central division of zebrafish pallium respond to change in visual numerosity. bioRxiv Published online November 11, 2020. https://doi.org/10.1101/2020.11.11.377804.
Messina, A. et al. (2020). Response to change in the number of visual stimuli in zebrafish: a behavioural and molecular study. Sci. Rep. 10, 5769.
Miletto Petrazzini, M.E. et al. (2015). Relative versus absolute numerical representation in fish: can guppies represent “fourness”? Anim. Cogn. 18, 1007–1017.
Miletto Petrazzini, M.E. et al. (2017). Quantitative abilities in a reptile (Podarcis sicula). Biol. Lett. 13, 20160899.
Miletto Petrazzini, M.E. et al. (2018). Quantity discrimination in trained lizards (Podarcis sicula). Front. Psychol. 9, 274.
Moll, F.W. and Nieder, A. (2015). Cross-modal associative mnemonic signals in crow endbrain neurons. Curr. Biol. 25, 2196–2201.
Moroz, L.L. (2009). On the independent origins of complex brains and neurons. Brain Behav. Evol. 74, 177–190.
Mueller, T. et al. (2011). The dorsal pallium in zebrafish, Danio rerio (Cyprinidae, Teleostei). Brain Res. 1381, 95–105.
Nasr, K. et al. (2019) Number detectors spontaneously emerge in a deep neural network designed for visual object recognition. Sci. Adv. 5, eaav7903.
Nelson, X.J. and Jackson, R.R. (2012). The role of numerical competence in a specialized predatory strategy of an araneophagic spider. Anim. Cogn. 15, 699–710.
Nieder, A. (2012). Supramodal numerosity selectivity of neurons in primate prefrontal and posterior parietal cortices. Proc. Natl. Acad. Sci. U. S. A. 109, 11860–11865.
Nieder, A. (2016). Representing something out of nothing: the dawning of zero. Trends Cogn. Sci. 20, 830–842.
Nieder, A. (2016). The neuronal code for number. Nat. Rev. Neurosci. 17, 366–382.
Nieder, A. (2017). Evolution of cognitive and neural solutions enabling numerosity judgements: lessons from primates and corvids. Philos. Trans. R. Soc. Lond. B Biol. Sci. 373, 20160514.
Nieder, A. (2017). Inside the corvid brain – probing the physiology of cognition in crows. Curr. Opin. Behav. Sci. 16, 8–14.
Nieder, A. (2019). A Brain for Numbers: The Biology of the Number Instinct, MIT Press.
Nieder, A. (2020). The adaptive value of numerical competence. Trends Ecol. Evol. 35, 605–617.
Nieder, A. (2021). The Evolutionary History of Brains for Numbers. Trends in Cognitive Sciences, 25(7), 608-621.
Nieder, A. and Miller, E.K. (2004). A parieto-frontal network for visual numerical information in the monkey. Proc. Natl. Acad. Sci. U. S. A. 101, 7457–7462.
Nieder, A. et al. (2002). Representation of the quantity of visual items in the primate prefrontal cortex. Science 297, 1708–1711.
Nieder, A. et al. (2006). Temporal and spatial enumeration processes in the primate parietal cortex. Science 313, 1431–1435.
Nieder, A. et al. (2020). A neural correlate of sensory consciousness in a corvid bird. Science 369, 1626–1629.
Nieuwenhuys, R. (2009). The forebrain of actinopterygians revisited. Brain Behav. Evol. 73, 229–252.
Nomura, T. et al. (2018). Species-specific mechanisms of neuron subtype specification reveal evolutionary plasticity of amniote brain development. Cell Rep. 22, 3142–3151.
Nomura, T. et al. (2020). Changes in Wnt-dependent neuronal morphology underlie the anatomical diversification of neocortical homologs in amniotes. Cell Rep. 31, 107592.
Ofstad, T.A. et al. (2011). Visual place learning in Drosophila melanogaster. Nature 474, 204–207.
Okuyama, S. et al. (2015). Representation of the numerosity ‘zero’ in the parietal cortex of the monkey. Sci. Rep. 5, 10059.
Olkowicz, S. et al. (2016). Birds have primate-like numbers of neurons in the forebrain. Proc. Natl. Acad. Sci. U. S. A. 113, 7255–7260.
Owald, D. and Waddell, S. (2015). Olfactory learning skews mushroom body output pathways to steer behavioral choice in Drosophila. Curr. Opin. Neurobiol. 35, 178–184.
Pepperberg, I.M. (2006). Grey parrot numerical competence: a review. Anim. Cogn. 9, 377–391.
Perdue, B.M. et al. (2012). Putting the elephant back in the herd: elephant relative quantity judgments match those of other species. Anim. Cogn. 15, 955–961.
Pfeiffer, K. and Homberg, U. (2014). Organization and functional roles of the central complex in the insect brain. Annu. Rev. Entomol. 59, 165–184
Ramirez-Cardenas, A. et al. (2016). Neuronal representation of numerosity zero in the primate parieto-frontal number network. Curr. Biol. 26, 1285–1294.
Rinnert, P. and Nieder, A. (2021). Neural code of motor planning and execution during goal-directed movements in crows. J. Neurosci. Published online February 19, 2021. https://doi.org/10.1523/JNEUROSCI.0739-20.2021.
Rinnert, P. et al. (2019). Neuronal correlates of spatial working memory in the endbrain of crows. Curr. Biol. 29, 2616–2624.e4.
Rodríguez, R.L. et al. (2015). Nephila clavipes spiders (Araneae: Nephilidae) keep track of captured prey counts: testing for a sense of numerosity in an orb-weaver. Anim. Cogn. 18, 307–314.
Rose, G.J. (2017). The numerical abilities of anurans and their neural correlates: insights from neuroethological studies ofacoustic communication. Philos. Trans. R. Soc. Lond. B Biol. Sci. 373, 20160512.
Rugani, R. et al. (2013). One, two, three, four, or is there something more? Numerical discrimination in day-old domestic chicks. Anim. Cogn. 16, 557–564.
Sawamura, H. et al. (2002). Numerical representation for action in the parietal cortex of the monkey. Nature 415, 918–922.
Sawamura, H. et al. (2010). Deficits in action selection based on numerical information after inactivation of the posterior parietal cortex in monkeys. J. Neurophysiol. 104, 902–910.
Scarf, D. et al. (2011). Pigeons on par with primates in numerical competence. Science 334, 1664.
Schnell, A.K. and Vallortigara, G. (2019). ‘Mind’ is an illdefined concept: considerations for future cephalopod research. a reply to Mather, Octopus Mind. Anim. Sentience 26, 16.
Schnell, A.K. et al. (2020). How intelligent is a cephalopod? Lessons from comparative cognition. Biol. Rev. Camb. Philos. Soc. 96, 162–178.
Shamble, P.S. et al. (2016). Airborne acoustic perception by a jumping spider. Curr. Biol. 26, 2913–2920.
Shigeno, S. and Ragsdale, C.W. (2015). The gyri of the octopus vertical lobe have distinct neurochemical identities. J. Comp. Neurol. 523, 1297–1317.
Shomrat, T. et al. (2015). The vertical lobe of cephalopods: an attractive brain structure for understanding the evolution of advanced learning and memory systems. J. Comp. Physiol. A. 201, 947–956.
Stacho, M. et al. (2020), A cortex-like canonical circuit in the avian forebrain. Science 369, eabc5534.
Stancher, G. et al. (2015). Numerical discrimination by frogs (Bombina orientalis). Anim. Cogn. 18, 219–229.
Starkey P, Cooper RG. (1980). Perception of numbers by human infants. Science 210:1033–35.
Stork, N.E. (2018). How many species of insects and other terrestrial arthropods are there on earth? Annu. Rev. Entomol. 63, 31–45.
Striedter, G.F. and Northcutt, R.G. (2020). Brains Through Time: A Natural History of Vertebrates, Oxford University Press.
Templeton, C.N. et al. (2005). Allometry of alarm calls: blackcapped chickadees encode information about predator size. Science 308, 1934–1937.
Thompson, R.F. et al. (1970). Number coding in association cortex of the cat. Science 168, 271–273.
Tomer, R. et al. (2010). Profiling by image registration reveals common origin of annelid mushroom bodies and vertebrate pallium. Cell 142, 800–809.
Tosches, M.A. et al. (2018). Evolution of pallium, hippocampus, and cortical cell types revealed by single-cell transcriptomics in reptiles. Science 360, 881–888.
Tsuboi, M. et al. (2018). Breakdown of brain–body allometry and the encephalization of birds and mammals. Nat. Ecol. Evol. 2, 1492–1500.
Vallentin, D. et al. (2012). Numerical rule coding in the prefrontal, premotor, and posterior parietal cortices of macaques. J. Neurosci. 32, 6621–6630.
Van Essen, D.C. and Dierker, D.L. (2007). Surface-based and probabilistic atlases of primate cerebral cortex. Neuron 56, 209–225.
Vasas, V. and Chittka, L. (2019). Insect-inspired sequential inspection strategy enables an artificial network of four neurons to estimate numerosity. iScience 11, 85–92.
Veit, L. et al. (2015). Associative learning rapidly establishes neuronal representations of upcoming behavioral choices in crows. Proc. Natl. Acad. Sci. U. S. A. 112, 15208–15213.
Viswanathan, P. and Nieder, A. (2013). Neuronal correlates of a visual “sense of number” in primate parietal and prefrontal cortices. Proc. Natl. Acad. Sci. U. S. A. 110, 11187–11192.
Viswanathan, P. and Nieder, A. (2015). Differential impact of behavioral relevance on quantity coding in primate frontal and parietal neurons. Curr. Biol. 25, 1259–1269.
Wagener, L. et al. (2018). Neurons in the endbrain of numerically naive crows spontaneously encode visual numerosity. Curr. Biol. 28, 1090–1094 e4.
Wang, L. et al. (2020). Cuckoos use host egg number to choose host nests for parasitism. Proc. Biol. Sci. 287, 20200343.
Wilson ML, Hauser MD, Wrangham RW. (2001). Does participation in intergroup conflict depend on numerical assessment, range location, or rank for wild chimpanzees? Anim. Behav. 61:1203–16.
Wynn K. (1992). Addition and subtraction by human infants. Nature 358:749–50.
Yang, T.I. and Chiao, C.C. (2016). Number sense and statedependent valuation in cuttlefish. Proc. Biol. Sci. 283, 20161379.
Young, J.Z. (1963). The number and sizes of nerve cells in Octopus. Proc. Zool. Soc. Lond. 140, 229–254.
Zullo, L. et al. (2009). Nonsomatotopic organization of the higher motor centers in octopus. Curr. Biol. 19, 1632–1636.
本文来自微信公众号:nextquestion(ID:gh_2414d982daee),编译:顾海成,编辑:Jiahui,Lixia,EY
