

扫码打开虎嗅APP
本文来自微信公众号:返朴 (ID:fanpu2019),作者:顾舒晨,原文标题:《“我们中出现了叛徒”:神经系统不只是癌症的受害者,还有带路党》,题图来自:视觉中国
神经系统几乎影响有机体的所有组织,而对于癌症,长久以来科学家都认为神经系统是受害者,但近30年来的研究发现神经系统可以主动参与调控恶性肿瘤发生和发展。这距离首次发现癌症与神经系统之间的联系过去了150年。
如今,探究癌症与神经系统相互作用已经成为了前沿热点,这就是癌症神经学。人们发现癌细胞可以利用神经系统促进其生长和扩散,甚至改变神经系统的功能为其营造合生长的微环境。这一领域还有太多的未解之谜,当然也为治疗癌症带来了新的机遇。
癌症,恶性肿瘤的统称,人们往往谈之色变。虽然自1912年巴黎医生加斯顿·奥丁(Gaston Odin)首次从肿瘤中分离出癌细胞起,人们就开始了对癌症的研究,但至今我们依然没有揭开癌症的全貌,无法完全攻克癌症。
在过去十年中,科学家们已经意识到癌症并不只是一种局部病变,而是一种牵涉到整个有机体的系统问题——癌细胞会创造适合其生存的生态系统来帮助它们生长并扩散到新的地方。
因此,癌基因和肿瘤的微环境(指癌细胞和它存在的周围微环境,包括免疫细胞、内皮细胞、成纤维细胞,以及其他细胞种类等)一直是癌症研究的重中之重。尽管它们在癌症的发生发展中确实非常重要,但这并不完整,例如神经系统长久以来都没被提到过。

图片来源:参考文献[6],图1,3D细胞成像展示神经细胞(品红色)如何与癌细胞(绿色)相互作用。
一、癌症与神经系统联系的发现
从神经学的角度看,大脑协调着所有发生在我们体内的化学过程,是身体的主要调控器。大脑通过神经系统和血液循环中的化学信号收集关于身体的信息,然后分析这些信息,并将化学信号通过神经元传递给不同器官、肌肉和腺体,从而影响这些组织器官的运作。
神经系统控制着正常组织的一切活动,例如生长、萎缩,或者是其他任何过程。而癌细胞的发展也需要这些功能,从逻辑上考虑,它们也需要神经系统的支持。
事实上,科学家很早就发现了癌细胞与神经元之间的联系。19世纪中叶,法国解剖学家和病理学家让-克鲁维耶(Jean Cruveilhier)描述了一例乳腺癌侵犯负责面部运动和感觉的颅神经的病例[1]。癌细胞在神经周围穿梭,然后扩散。他认为这种现象是侵袭性肿瘤的标志,预示着病人的健康状况不佳。这便是关于神经周围侵犯的首次描述。
但是,在这之后的很长一段时间里,科学家和医生都认为神经系统是“受害者”,癌细胞破坏了它的结构,神经系统被动地充当了运输癌细胞及其相关疼痛的高速公路。直到20世纪90年代末,现就职于得克萨斯大学健康科学中心的Gustavo Ayala教授开始对这种相互作用进行更深入的研究。
他发现神经不仅仅是被动的“受害者”,它们还会主动寻求与癌症建立联系。他把小鼠的神经放在布满人类前列腺癌细胞的培养皿中,在24小时内,神经就开始向癌细胞长出名为神经元的小分支。并且这些神经元一旦与癌细胞接触,癌细胞就会沿着神经移动,直到到达神经细胞体[2]。
2008年的一项研究同样指出,与健康前列腺样本相比,前列腺癌含有更多的神经纤维(轴突)[3]。这暗示着癌细胞正在利用神经系统。
于是,学界开始关注神经系统与癌症的关系。2013年的一项研究证实,在小鼠中切断癌细胞与神经系统的连接可使疾病停滞[4]。接下来的几年里,大量研究表明,在其他部位的癌症中也发生了同样的事情,包括胃癌、胰腺癌和皮肤癌[5]。
2023年发表在Nature杂志的论文“Glioblastoma remodelling of human neural circuits decreases survival”表明,癌细胞甚至可以将自己连接到神经回路中,直接接受来自神经元的刺激,促进肿瘤的生长[6]。
更“骇人听闻”的是,人们有意识的思考,以及通过语言机制进行的心智活动(这些均为神经活动),似乎都会促进神经胶质瘤的发生与发展。
二、癌症与神经系统的华尔兹
随着科学技术手段的发展,研究人员逐渐揭开了癌症与神经系统相互作用的神秘面纱。他们发现某些癌症中的癌细胞不仅能够发出信号,诱导神经纤维向癌细胞生长,还能借用已存在的神经通路让癌细胞扩散到其他器官。
此外,癌细胞还能够影响神经细胞的功能,甚至改变其生物学状态,以适应癌细胞本身的生长需要。科学家们还发现某些器官的癌症对神经有特别的偏好,比如乳腺癌和前列腺癌的癌细胞就倾向于寻找和入侵神经并通过神经扩散,就好像在神经末端和肿瘤之间存在着某种暗中交易。
目前已发现癌细胞能够通过以下三种方法有效地“劫持神经系统”,为其生长提供支持:释放电信号、通过神经元直接连接和释放神经生长因子。
2019年发表在Nature杂志的两篇文章[7, 8]都证实了神经胶质瘤细胞具有电生理活性,它们不仅能够产生电信号,还能够接收和响应来自神经元的电信号。癌细胞利用这种电信号的交流促进自身的生长、扩散以及向其他器官的转移。
同时,这些研究也证实了神经胶质瘤细胞能够模仿神经元行为形成类似神经突触的结构,从而与神经系统建立直接的物理联系。通过这种伪装,癌细胞可以偷取许多信号分子,反过来促进自己的生长。
而这种能够模仿神经元的癌细胞不仅仅只存在于脑部的神经胶质瘤,在乳腺癌中也存在这样的现象[9]。另有研究发现,胰腺癌在缺乏能量时则能够分泌神经生长因子(NGF),驱使神经元细胞轴突分泌丝氨酸,为胰腺癌细胞提供营养支持[10]。
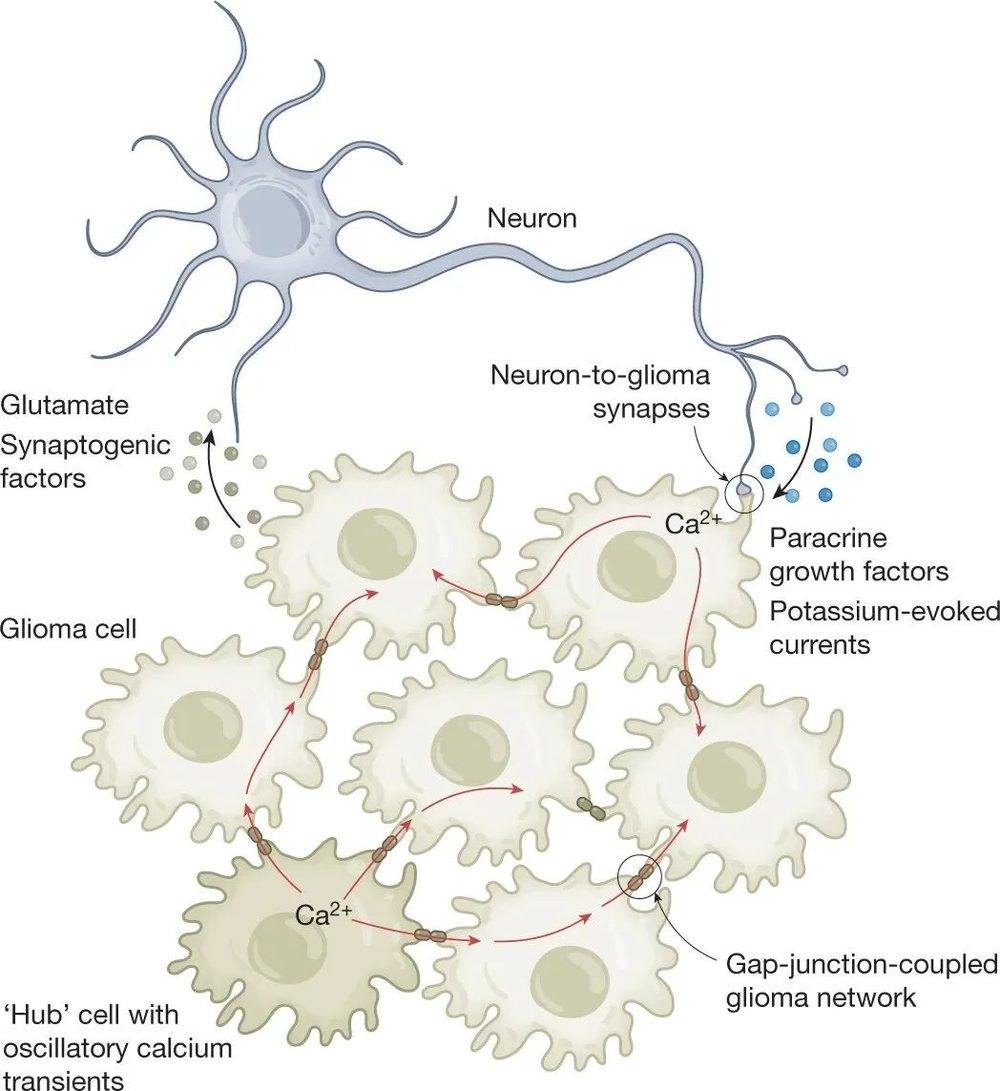
图片来源:参考文献[5],图2,中枢神经系统中神经元-胶质瘤的相互作用。
除了癌症对神经系统的“劫持”,神经系统也能通过提供适合癌症生长的微环境以及抑制免疫系统监控的方式促进癌症的生长。例如,神经分泌的神经源性因子——神经生长因子(NGF)[11]和脑源性神经营养因子(BDNF)[12]等,可以直接作用于癌细胞,促进其生存和扩散。
神经纤维的入侵还可以促进血管新生,为肿瘤中的癌细胞提供更多的营养供应,加速其生长速度[13]。而神经细胞分泌的一些神经递质和神经肽,如去甲肾上腺素和伽玛氨基丁酸(GABA),能够抑制免疫细胞的活性,减少它们对癌细胞的攻击。
这种抑制作用不仅限于肿瘤局部的免疫反应,也影响到全身的免疫状态,使得癌细胞能够在一个相对“安全”的环境中生长和扩散[12]。在慢性应激的情况下,身体也会通过激活交感神经系统来调节免疫反应,这种状态下的免疫细胞表现出对肿瘤的较低反应性,为癌细胞的生长创造了条件[14]。
但神经也不总是在“助攻”癌症的生长。由于神经系统本身就有不同的类型,发挥着不同的功能,因此它们对癌症的影响也是复杂的,甚至出现“矛盾”的行为。
例如,在胰腺中,交感神经参与了助长癌细胞生长的恶性前馈循环,但负责“休息和消化”功能的副交感神经则会发出化学信息,阻止疾病的发展[15];在胃癌中,副交感神经信号的作用恰恰相反,它们会促进癌细胞生长[16]。
而在前列腺癌中,这两种神经都会“帮助”癌细胞,交感神经在癌症发展的早期阶段提供帮助,而副交感神经则会促进后期癌细胞的扩散[17]。这些研究都说明每种癌症与神经系统的相互作用方式都有些不同,需要针对性地研究和治疗。
三、治疗的希望
癌症与神经系统之间相互作用的研究对于癌症的治疗具有重要意义。它不仅能够为目前某些现象,例如“化疗脑”(指接受化疗的癌症患者会出现记忆力和其它认知功能下降等副作用)提供了可能的解释,更重要的是,这些研究能够为我们开发新的癌症治疗方法提供思路。
例如开发阻断神经信号传递给癌细胞的药物,从而抑制癌细胞的生长;或是利用神经阻断技术或手术方法来切断肿瘤与神经系统之间的物理连接,这一方法目前已经在一些癌症的治疗中显示出潜力[18]。而一些已有的神经系统药物,如β-阻断剂、抗抑郁药,也已经在小鼠试验中被证实可以抑制癌细胞的生长[18]。这些治疗方法的开发和应用都为癌症患者提供了新希望。
随着对癌症与神经系统相互作用机制理解的不断深入,还有许多的新领域需要探索:不同的癌细胞如何具体调控神经细胞的功能,这种调控对癌症进程的具体影响等。此外,神经系统对癌症微环境的影响,特别是如何通过神经系统调控肿瘤免疫微环境,也将是未来研究的另一个重要领域。
《癌症传》中写道:“每一部传记都会面临主角的死亡。那么癌症的终结是否能在未来成为可能?有没有可能从我们的身体和社会中永远根除这种疾病?”对于癌症的未来,至少现在有一个亟需探索的领域,或许能为攻克癌症带来新的突破。
参考文献
[1] Cruveilhier J. Maladies des nerfs. 2nd edition, Part 35. Paris: Baillière, 1835: 3.
[2] Ayala, G. E. et al. Prostate 49, 213–223 (2001).
[3] Ayala, G. E. et al. Clin. Cancer Res. 14, 7593–7603 (2008).
[4] Magnon, C. et al. Science 341, 1236361 (2013).
[5] Mauffrey, P. et al. Nature 569, 672–678 (2019).
[6] Krishna, S. et al. Nature 617, 599–607 (2023).
[7] Venkatesh, H. S. et al. Nature 573, 539–545 (2019).
[8] Venkataramani, V. et al. Nature 573, 532–538 (2019).
[9] Zeng, Q. et al. Nature 573, 526–531 (2019).
[10] Banh RS, et al. Cell. Nov 25;183(5):1202-1218.e25 (2020).
[11] Lin H, et al. Mol Med Rep. Apr;23(4):288 (2021).
[12] Balood, M. et al. Nature 611, 405–412 (2022).
[13] Huang D, et al. Nat Cell Biol. Feb;24(2):230-241 (2022).
[14] Wentao Tian, et al. Front Cell Dev Biol. Nov 19;9:777018 (2021).
[15] Renz BW, et al. Cancer Discov 8:1458–73 (2018).
[16] Zhao CM, et al. Sci Transl Med 6:250ra115 (2014).
[17] Magnon C, et al. Science 341:1236361 (2013).
[18] Winkler F. et al. Cell. Apr 13;186(8):1689-1707 (2023).
本文来自微信公众号:返朴 (ID:fanpu2019),作者:顾舒晨
