

扫码打开虎嗅APP
本文来自微信公众号:奇点网(ID:geekheal_com),作者:代丝雨,原文标题:《<细胞>:癌细胞竟和T细胞抢饭吃!科学家首次发现肥胖会重塑肿瘤微环境代谢,癌细胞趁机多吃,抑制T细胞浸润和功能 | 科学大发现》,题图来自:视觉中国
肥胖是多种疾病的风险因素,其中包括13种癌症[1]。根据统计数据,在美国30岁以上的癌症患者中,男女分别有约5%和10%归因于肥胖[2]。近年来,随着医疗技术的发展,癌症总发病率逐年下降,但是一些与肥胖相关的癌种,比如肝癌、胰腺癌、结直肠癌、甲状腺癌和子宫癌却在上升[1]。
肥胖会带来机体代谢系统的紊乱,并改变细胞功能,比如肠上皮细胞的转录和表观遗传变化,就有利于结直肠癌的发生和进展[3]。
不过呢,既往的研究都主要集中于癌细胞本身,对于肥胖所诱导代谢变化如何影响肿瘤微环境(TME),还从未有报道出现。
肿瘤的特征之一就是对营养的极大需求,考虑到实体瘤内供血有限,癌细胞对营养物质的高消耗,是否会抢占其他细胞,尤其是抗肿瘤免疫急需的T细胞的营养配额呢?
本周,哈佛医学院科研团队发表在《细胞》杂志上的一项研究成果首次为我们系统地分析了饮食诱导的肥胖如何改变TME的代谢[4]。利用多组学方法,科学家们发现,在高脂饮食的条件下,癌细胞可以灵活地上调游离脂肪酸途径,更多地摄取脂质,间接地抑制了CD8+T细胞的肿瘤浸润和抗肿瘤功能。
通过基因干预癌细胞的代谢重编程,可以缓解“营养物质的紧缺”,并促进免疫系统重掌大权。
研究者尝试通过高脂饮食(HFD)喂养研究肥胖和TME之间的关系。实验中使用的对照组鼠粮里13.2%的卡路里来自脂肪,而HFD组鼠粮则60%由脂肪供能。经过8~10周的喂养,HFD组小鼠显著变重了,同时还出现了高胆固醇血症、轻度高血糖以及其他肥胖相关的代谢变化。
当小鼠习惯了饮食方案之后,研究者给它们植入了MC38结直肠腺癌细胞,并观察到HFD组小鼠中肿瘤生长得更快。
有趣的是,MC38是一种高免疫原性肿瘤细胞,当研究者在另一组实验中分别给小鼠植入了高免疫原性的E0771乳腺腺癌细胞、中度免疫原性的B16黑色素瘤细胞和低免疫原性的Lewis肺癌细胞(LLC),他们发现,免疫原性越高,在HFD下生长速度增长得就越快,而低免疫原性的LLC基本不受影响。
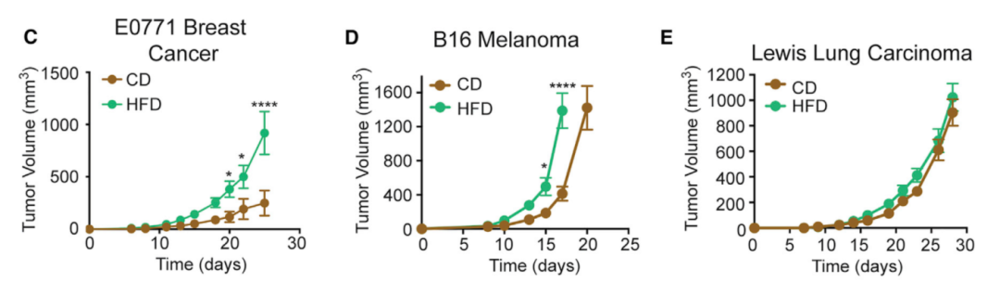
高免疫原性细胞受HFD影响更强
看起来HFD带来的影响并不是直接促进肿瘤的生长,而是抑制了免疫的功能!当研究者将MC38植入缺乏正常T细胞的小鼠体内,果然HFD的促癌效果就无法复现了。
进一步研究显示,HFD MC38肿瘤中CD8+T细胞水平较少,而且这是肿瘤特有的,因为脾脏和引流淋巴结中并没有观察到类似的减少。不仅数量较少,这些CD8+T细胞的扩增较少,激活水平也比较低,也就是说HFD使得T细胞的浸润能力和抗肿瘤功能都削弱了。
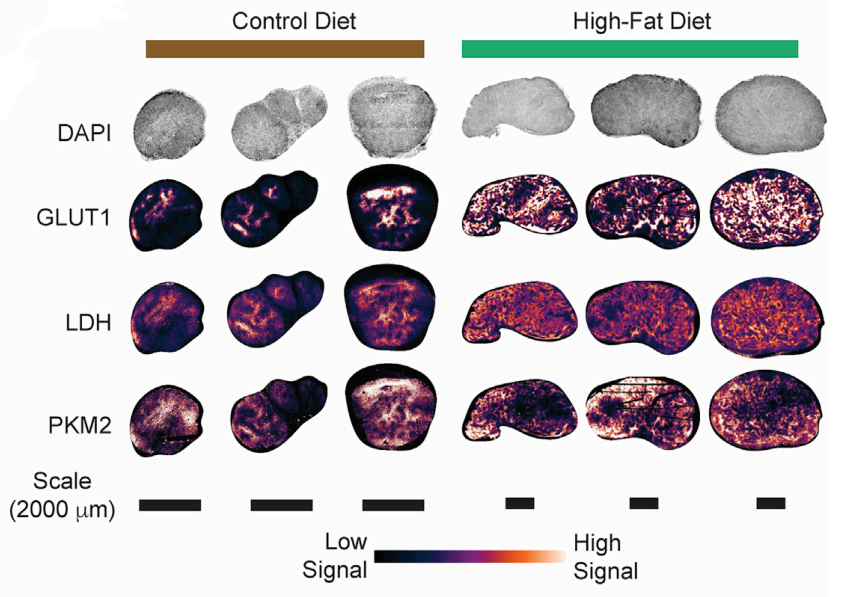
分析显示HFD中高糖酵解区域与CD8+T细胞分布显著不重叠
这是为什么呢?
通过单细胞测序分析,研究者发现HFD下,癌细胞和T细胞的代谢适应性有很大的差异。为了搞清楚其中的变化,研究者们分析了1800多个代谢基因和四类GO集,结果发现了一个关键的基因,Phd3。
Phd3在肿瘤中表达显著降低,但是奇怪的是,在CD8+T细胞中,却没有发生Phd3表达的变化。
Phd3是proly羟化酶家族的成员,与缺氧反应调节有关,也参与炎症和免疫控制相关信号通路。曾有研究发现,Phd3可以通过抑制长链脂肪酸进入线粒体来调节脂肪酸氧化(FAO)[5]。
由此,研究者进一步分析了一组与FAO代谢有关的基因,结果显示在HFD癌细胞中,它们出现了全面的变化,对FAO有促进作用,但相似的变化在CD8+T细胞中是不存在的。
接下来研究者用染色剂标记了脂肪酸,发现MC38癌细胞和T细胞中存储的脂质水平是类似的,但是HFD癌细胞对脂肪酸的摄入明显增加了,这极有可能影响到T细胞对脂质的摄取。
也就是说,在HFD条件下,物质极大丰富,癌细胞立刻适应了富裕的生活,大肆吃喝,结果很可能搞得T细胞没得吃了!
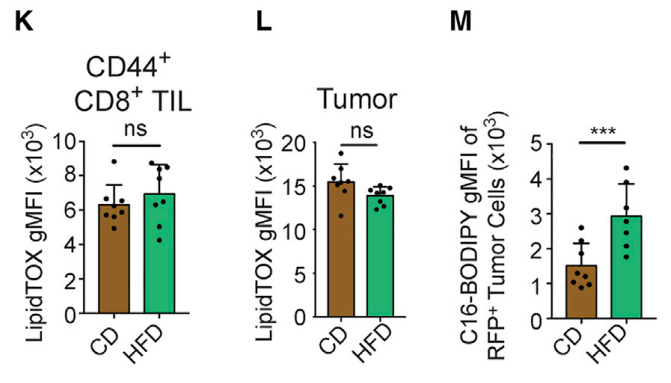
HFD使得癌细胞对脂质的摄取增加
当研究者通过基因手段使MC38细胞过表达Phd3,抑制了它的代谢改变,果然HFD的促癌作用就不那么有力了,CD8+T细胞的抗肿瘤功能也变强了。
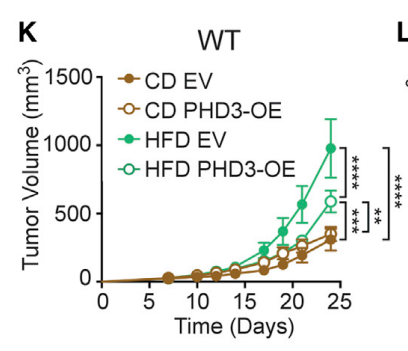
Phd3过表达削弱了肿瘤的生长
从癌症基因组图谱(TCGA)数据库中获得的数据集显示,BMI在30以上的肥胖患者中,Phd3的表达显著降低,癌组织中Phd3的表达也比正常组织更少。同时,严重肥胖患者肿瘤中的CD8+T细胞浸润显著减少,“冷肿瘤”的可能性更高。
由此看来,肥胖对TME代谢的影响在人类中也是存在的,这个Phd3很有可能就是未来可用的新靶点呀。
参考资料:
[1] Lauby-Secretan, B., Scoccianti, C., Loomis, D., Grosse, Y., Bianchini, F., and Straif, K.; International Agency for Research on Cancer Handbook Working Group (2016). Body Fatness and Cancer–Viewpoint of the IARC Working Group. N. Engl. J. Med. 375, 794–798.
[2] Islami, F., Goding Sauer, A., Gapstur, S.M., and Jemal, A. (2018). Proportion of Cancer Cases Attributable to Excess Body Weight by US State, 2011-2015. JAMA Oncol. 5, 384–392.
[3] Beyaz, S., Mana, M.D., Roper, J., Kedrin, D., Saadatpour, A., Hong, S.-J., Bauer- Rowe, K.E., Xifaras, M.E., Akkad, A., Arias, E., et al. (2016). High-fat diet enhances stemness and tumorigenicity of intestinal progenitors. Nature 531, 53–58.
[4]https://www.cell.com/cell/fulltext/S0092-8674(20)31526-9#%20
[5] German, N.J., Yoon, H., Yusuf, R.Z., Murphy, J.P., Finley, L.W.S., Laurent, G., Haas, W., Satterstrom, F.K., Guarnerio, J., Zaganjor, E., et al. (2016). PHD3 Loss in Cancer Enables Metabolic Reliance on Fatty Acid Oxidation via Deactivation of ACC2. Mol. Cell 63, 1006–1020.
本文来自微信公众号:奇点网(ID:geekheal_com),作者:代丝雨
