

扫码打开虎嗅APP
本文来自微信公众号:CC情报局(ID:cancer-weekly),作者:温迪(美国执业医生和生物医学博士,凤凰网《肿瘤情报局》特约专家),原文标题:《死亡风险降89%,在家吃药就有效?辉瑞口服药将改变疫情未来》,头图来自:视觉中国
一
辉瑞新冠口服新药效果超越默克抗病毒药?能降89%重症与死亡风险?
继默克开发出了新冠口服新药Molnupiravir莫纳皮拉韦一个月后,美国时间11月5日,辉瑞也宣布开发出了一款口服新药PAXLOVID,并公布了它II/III期临床中期试验的结果。

这个口服药Paxlovid可以降低重症与死亡达到89%。
这项实验结果远远好于吉利德的静脉注射药物remdesivir瑞德西韦,比默克的莫纳皮拉韦(molnupiravir)10月份公布的数据更好。莫纳皮拉韦当时的实验结果显示,重症/死亡风险可以降低约50%。
辉瑞Paxlovid和莫纳皮拉韦一样,都是针对新冠轻症但有演变成重症危险因素的病人。目标都是让轻症病人在家疗养时能够自行口服用药,减轻医院负担。
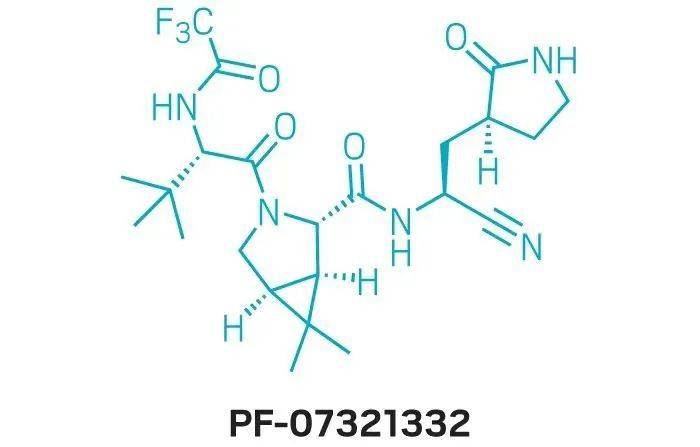
但与默克的新冠口服药不一样的是,辉瑞公司的抗新冠病毒药片为复方制剂。辉瑞是把既有的抗病毒药物利托那韦(ritonavir)和新开发的这款病毒抑制剂PF-07321332共同服用,在感染早期阻断病毒复制,控制病情,让病人康复得更快。
11月4日,英国政府已经核准莫纳皮拉韦透过EUA上市,成为对抗新冠肺炎的第一款口服药。市场预计辉瑞这款口服药将可能在今年年内获得紧急便用授权。
二
利托那韦是一款经试验证实对新冠无用的抗艾滋病用药,辉瑞新冠口服药为何会选择联合使用?
辉瑞Paxlovid包括两种成分:PF-07321332和利托那韦。
PF-07321332是一种蛋白酶抑制剂,用来阻断新冠病毒复制所需的主要蛋白酶SARS-CoV-2-3CL的活性,从而阻断病毒RNA复制。
利托那韦则是一款于2000年就上市的抗艾滋药物,此前和洛匹那韦合用,在中国和其他国家的临床试验中都没有显示出对新冠有效果。世界卫生组织正式宣布反对用这个联合方式治疗新冠。
但此次低剂量利托那韦联合用药,目的是减缓 PF - 07321332 在体内的代谢/分解,以使其在体内保持较高的浓度来对抗病毒。因此,这两种药物联合使用,治疗效果更好。
PF - 07321332 是第一个专为对抗新冠病毒而设计的小分子药物,辉瑞在抗病毒的蛋白酶抑制剂方面有丰富的经验。
这个药的研发,是站在前人科研的肩膀上。萨斯流行之后,科学家发现一种注射用药PF-00835231 可以抑制萨斯病毒的蛋白酶。新冠疫情以来,这种药被发现对新冠病毒也有抑制作用。在此基础上科学家改变了结构,设计出针对新冠病毒而且可以口服的新药PF-07321332,即Paxlovid的活性成分。
辉瑞Paxlovid从设计到临床试验成功只花了不到两年的时间,是前无古人的神速,而以后可能也很难打破这个纪录。
据科普达人庄时利和解释,PF-07321332对病毒的抑制活性非常强,在表达ACE2蛋白的几种细胞中,PF-07321332的IC50(半抑制浓度 )IC50在56-99nM之间。要知道IC50越低,抑制病毒的活性越强,做个对比,默沙东的Molnupiravir为220 nM,吉利德的瑞德西韦则是651 nM。

三
即使是出现症状5天内,仍然极其有效。
再来详细解读一下辉瑞这款新冠口服药的临床试验数据。
该临床试验今年7月开始入组,截至2021年9月29日入组的1219名成人,志愿者来自北美、南美、欧洲、非洲、亚洲的临床试验基地,其中45%的患者位于美国。
入选者的条件是:
在五天内被实验室确诊为新冠病毒感染;
并伴有轻度至中度症状;
至少有一个转为重症的风险因素。
一半患者随机服用PAXLOVID,另一半随机服用安慰剂,每12小时口服一次,一天两次,整个疗程共5天。
总的来说,在三期临床试验中,追踪28天的结果是:
996人服用Paxlovid,9人住院,没有人死亡;
997人服用安慰剂,则有68人住院,10人死亡;
吃药将住院/死亡减少了十分之九。
那,PAXLOVID安全吗?
安全性数据来自1881名患者:
两组人的副作用百分比相当,PAXLOVID是19%,安慰剂是21%,其中大多数是轻度的。
和安慰剂相比,使用PAXLOVID的患者发生的严重不良事件(1.7%对6.6%)和因不良事件而停止吃药(2.1%对4.1%)的情况都比较少。
因为中期结果显示了显著的疗效,根据独立的数据监测委员会的建议,并且和FDA讨论之后,辉瑞将停止进一步招募受试者,并提交这些数据给美国FDA,申请紧急使用授权。
同时,PAXLOVID正在进行两项进一步的临床试验。
一项试验是面向普通人,用来评估这个药对没有高危风险的一般人的效果。其中包括一批打了疫苗以后还被感染新冠的病人,随着接种率的不断提高,这批疫苗后感染的病人会越来越多,所以研究这个人群有很大现实意义。这个2/3期临床试验已于8月份启动。
另一项预防性试验的对象是有症状新冠病人的家属,密切接触后马上吃药,看能不能防止他们不被传染。这个2/3期临床试验已于9月27日启动。
这两项试验比今天宣布好消息的试验晚1-2个月启动,估计不需要很久我们就会听到中期结果。
四
辉瑞的好消息是全世界的好消息?
11月5日,《科学》杂志以《辉瑞的好消息是全世界的好消息》为题,刊发了Derek Lowe博士的文章,他是化学博士和新药开发的专家。Lowe博士认为Paxlovid出现,对新冠治疗的意义十分重大,超过低塞米松。

他提到了三点预测:
如果辉瑞的Paxlovid和默沙东的molnupiravir联合用药,像抗艾滋病的鸡尾酒疗法一样,预计不仅可以起到更好的疗效,而且可以避免耐药病毒株的出现。
需要尽快地让全世界以便宜的价格用上Paxlovid。辉瑞已经表示在 “致力于努力实现公平得到药物”,并且它正在探索怎样让其他国家生产这个药,计划是根据各个国家的经济收入的不同,采用阶梯式的价格。所以,让我们拭目以待吧。
这个药会让大部分病人不需要住院了,会减少医疗系统的负担,而且很可能改变疫情的发展方向。

同时,两种口服抗新冠药的接连出现,也会改变整个新冠治疗的状况:
以前口服药这块市场在世界上是空白,有些没有疗效的“药”比如氯喹和伊维菌素趁机而入。随着两款有效口服药的诞生,预计那些药会被大众逐渐淘汰。
需要住院和注射的单克隆抗体,不仅治疗手续麻烦而且价格昂贵,预计用处会越来越少。
两款口服药都需要在诊断后5天内使用,因此尽快诊断极为重要。美国政府最近投入10亿美元,以发展家庭快速检测,预计在三个月内让大众以成本价获取快筛检测。
目前,美国政府已经预购了辉瑞的这款新药100多万剂,英国和澳大利亚等国家表示他们已经和辉瑞达成了供应协议分别是50万剂与10万剂。辉瑞公司在利托那韦上已投资了10亿美元,这清晰地表明辉瑞预计人类在今后几年内仍然要和新冠斗争。
本文来自微信公众号:CC情报局(ID:cancer-weekly),作者:温迪
