

扫码打开虎嗅APP
本文来自微信公众号:果壳 (ID:Guokr42),作者:卤煮疫苗,题图来自:视觉中国
这几天一款由斯坦福大学研制的新冠疫苗,因为被脸书CEO马克·扎克伯格转发而爆红,甚至被媒体形容为“比mRNA疫苗强百倍”的“新冠终结者”。
这种新疫苗真的那么强吗?新冠大流行会因这种疫苗结束吗?
太长不看版:
“铁蛋白疫苗”还在临床前期,距离使用早着呢
抗体滴度高,但研究阶段尚在早期的动物阶段
“胜过mRNA疫苗百倍”缺乏数据支持
体液免疫(抗体)面临变异株的逃逸挑战
“终结新冠”还很遥远,但我们可以期待更好的疫苗让疾病风险越来越小
纳米颗粒疫苗
一说到新冠疫苗的研制路线,很多人第一反应肯定就能想到国内的灭活疫苗、病毒重组疫苗(腺病毒/流感病毒)、重组亚单位疫苗,以及海外研制的mRNA疫苗。但事实上新冠疫苗不止于此,研制平台还包括DNA疫苗、病毒样颗粒疫苗、基于抗原提呈细胞疫苗[1]等。
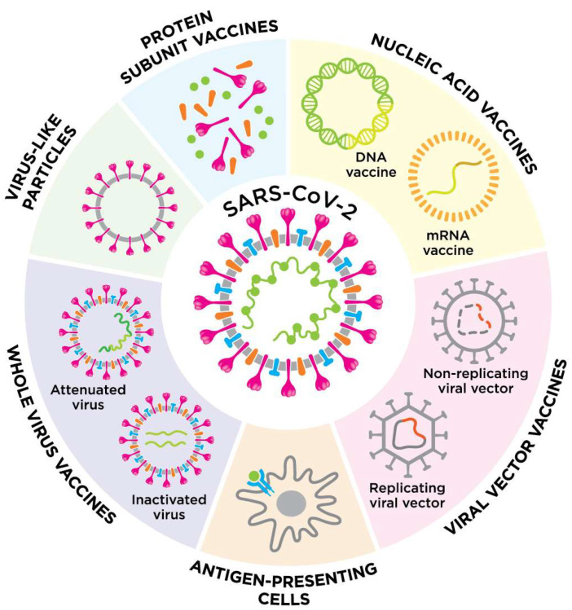
新冠病毒疫苗技术平台
而扎克伯格提到的“铁蛋白疫苗”,其实并不在上述归类当中,而是一种“纳米颗粒疫苗”。纳米颗粒(NP)由可生物降解的材料(聚乳酸、金属、脂质等)制成,由此制备的疫苗因其稳定性和递送机制(更容易被抗原提呈细胞所吸收,从而促进了B细胞激活),也被认为是一种可行的疫苗研制思路[2]。
更简单点说,“纳米颗粒疫苗”就像是我们常见的积木玩具,可以把病原体的抗原结构和其他颗粒组装到一起,成为“定制化抗原”,甚至把多种抗原融合在一起[3],也就是一次预防多种病原体的疫苗。

定制化抗原|翻翻
由于理论的可行性,包括中国在内的很多科研团队都在进行“纳米颗粒疫苗”的研制[3]-[6],当然也包括了今天我们的主角“铁蛋白疫苗”。
让人操心的抗体
为什么还要继续研究新的新冠疫苗?
原因就是现有的新冠疫苗“仍然不够好”。
随着时间的推移,无论是接种基础剂次还是加强剂次后,疫苗受种者体内的抗体降低[7]-[11],加之变异株的出现,突破感染的风险随之提高[12][13],这也让科学家们一直在努力寻找能产生更好免疫反应、保护更持久的新冠疫苗。
要知道,麻疹抗体半衰期估计长达3014年、水痘抗体半衰期估计长达92年[14](因此我们常说“终身免疫”),而新冠的中和抗体的半衰期仅有2个月左右,而且半年后半衰期仅有27天[15]。
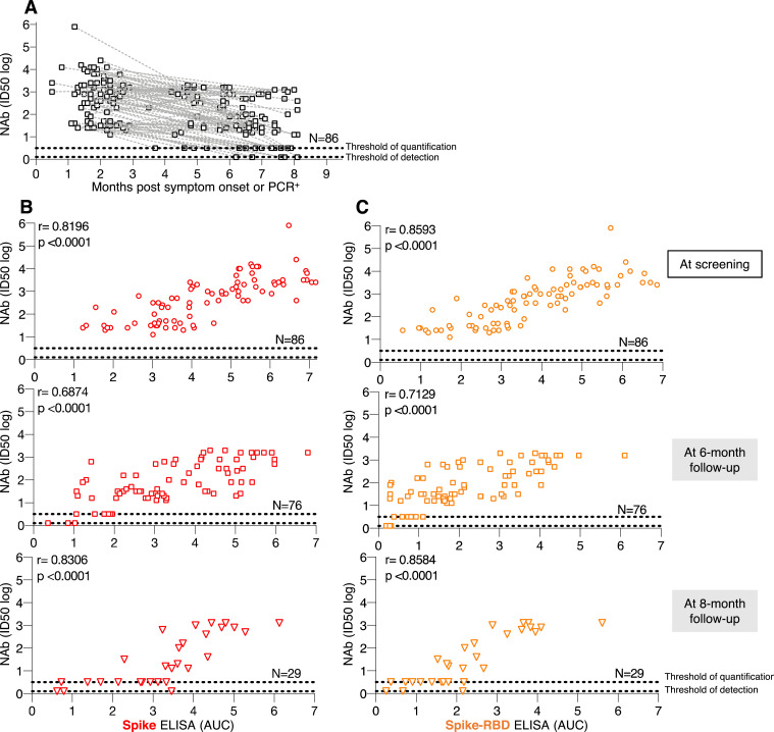
新冠中和抗体反应持久性
抗体减少快、变异株进一步降低抗体中和活性,那该怎么办呢?
俗话说(并没有):半衰期不够抗体量来凑!这次的“铁蛋白疫苗”诱导的超高抗体水平,就给人们带来了新的希望。
“铁蛋白疫苗”其实并不是一种官方叫法,这种由斯坦福大学的研究人员将铁蛋白作为核心制备的纳米颗粒疫苗的完整版名字叫……Delta-C70-Ferritin-HexaPro(DCFHP)。由于添加了氢氧化铝佐剂,所以官方全名叫DCFHP-alum。
那DCFHP-alum诱导的抗体有多强?借用扎克伯格的话说就是:比mRNA疫苗强100倍。

扎克伯格的Facebook动态
mRNA疫苗相较我国应用最广泛的灭活疫苗,能够产生更多针对S蛋白的特异性T细胞16反应以及更高的抗体水平[17],因此在保护效果上也存在一定优势[18],而DCFHP-alum要比mRNA疫苗抗体水平还要高100倍。
但这是否意味着可以终结新冠疫情了?
让我们先进一步了解下这个疫苗的研发细节与相关数据。
超级新冠疫苗
DCFHP-alum的相关研究[6]其实只是一篇发布在bioRxiv上的预印本,并未经过同行评议。但由于可以认为这是此前一项铁蛋白疫苗研究[19]的延续,因此内容同样值得参考。
在此前的研究中,斯坦福大学的研究者们采用了幽门螺旋杆菌铁蛋白,与新冠病毒的主要抗原棘突蛋白(S蛋白)的全长胞外域(S-Fer)或C末端70个氨基酸残基缺失(SΔC-Fer)结合,形成像海胆形状的纳米颗粒。

此前基于铁蛋白制备的纳米颗粒疫苗研究
其中,S∆C-Fer含有一个突变的弗林蛋白酶切割位点,和2-脯氨酸(2P)的融合前稳定替代物;S蛋白结构中被删除的70个残基中包含着免疫显性的、线性(非构象)的表位,而这些时常被抗体作为靶点的表位被删除后使S蛋白结构多价呈现。这种修饰让疫苗抗原能够诱导更广谱的抗体种类。
相较S-Fer,S∆C-Fer具有更好的免疫原性,因此可作为候选新冠疫苗进行研制。
而这一次发布预印本的研究可以说是将之前的S-Fer进行了一次升级,将四个脯氨酸替代物来补充了2-脯氨酸,创造出了一个六个脯氨酸替代物(HexaPro),升级后的抗原就是今天的主角DCFHP,而后者的稳定性也更好(意味着更有利于储运和应用)。
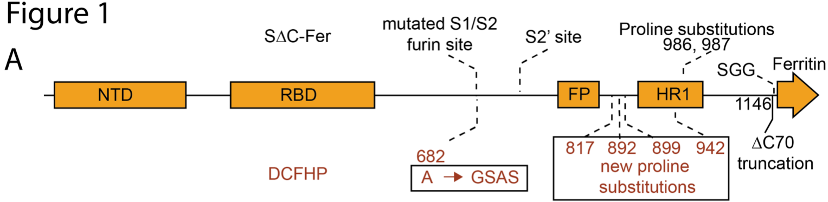
红色部分是与S∆C-Fer比DCFHP出现的变化
而通过这个方法制备的DCFHP-alum为小鼠和恒河猴接种后带来了积极结果,可以简单归纳为以下几点:
1.稳定性好:不需要超低温保存,DCFHP-alum在4-37℃环境下储存两周后依然能保持良好的免疫原性;
2.广泛覆盖变异株:采用0-21天(A组)或0-92天(B组)免疫程序接种2剂后,均能产生有效中和变异株的抗体;
3.对新变异株有效:B组的活性较A组高约4倍,且诱导的抗体对包括Omicron BQ.1、BQ.1.1在内的新冠病毒和SARS病毒均有中和活性;
4.免疫持久性好:所有的非人灵长类动物对新冠病毒原始毒株的中和抗体反应,都持续了至少250天;
5.T细胞免疫:接种疫苗后在动物体内产生平衡性的Th1和Th2免疫反应(但没有CD8+ T细胞反应);
6.可作为加强针接种:在第381天(第二剂次一年后)为恒河猴接种加强剂次后可诱导出与第二剂次接种后14天峰值相当的抗体水平。
*以上免疫原性数据均源自于体外假病毒中和试验
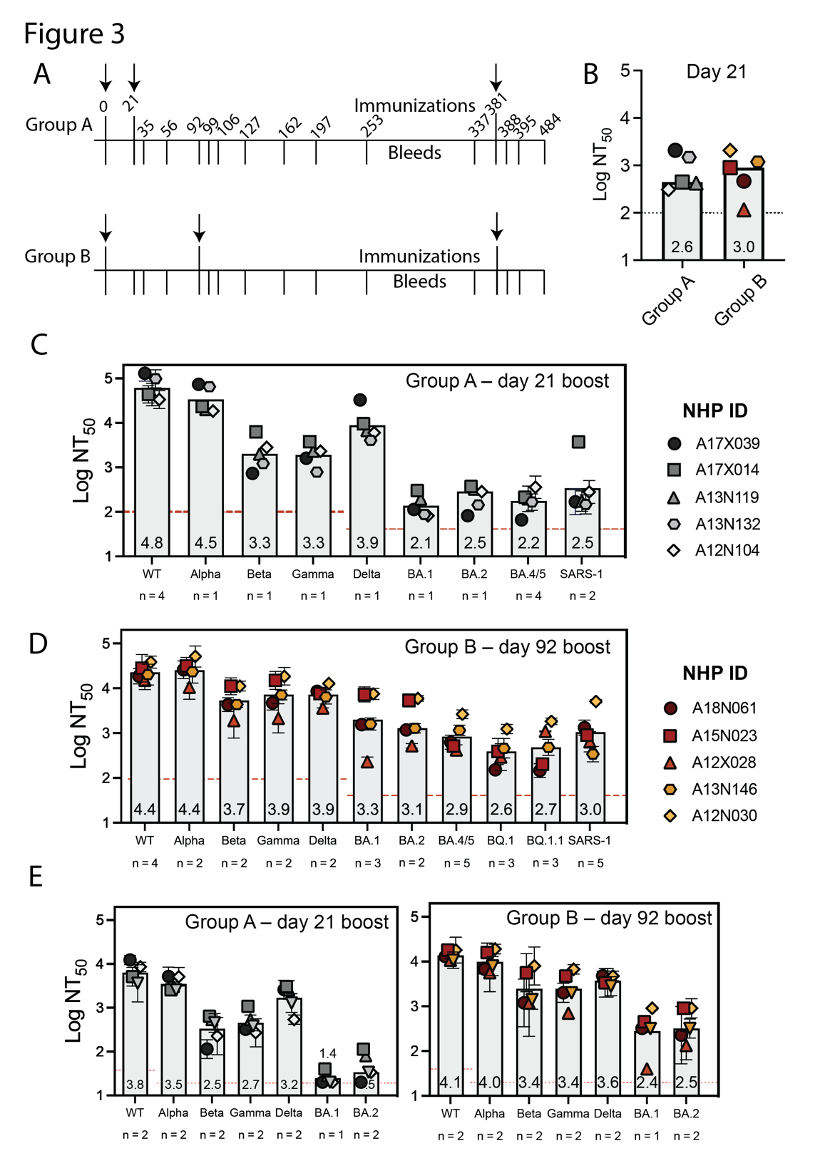
DCFHP-alum在非人灵长类动物中诱导的交叉免疫反应
综上,研究者认为DCFHP-alum新疫苗,低成本、高产量、稳定性好、能够提供高水平且持久的体液免疫,并且也能够诱导免疫记忆,可以作为一种新冠候选疫苗,而这种疫苗采用的氢氧化铝佐剂也经过数十年时间证明了其安全性,因此被认为甚至可以给婴儿接种。
至于抗体“比mRNA疫苗强100倍”的说法,研究者可没在文章中提到,只是扎克伯格自己说的——毕竟与斯坦福大学合作研究的另一个科研机构“Biohub”的全名叫做“Chan Zuckerberg Biohub”,是由扎克伯格和其妻子资助包括斯坦福大学在内的多所院校作为研究中心的非盈利机构[20]。
也就是说,小扎是给自己赞助的研究点了个赞,顺便狠夸了一下而已。
新冠终结者?
既然有这么好的疫苗,那是不是意味着新冠疫情可以正式终结了?或者说可以看到新冠病毒被消灭的曙光了?
其实还没。
DCFHP-alum疫苗尽管抗体反应或许比mRNA疫苗还要好,而且将包括灭活疫苗、mRNA疫苗在内的多个技术平台的新冠疫苗优点汇集在了一起,但我们仍需要清醒认识以下几点:
1.DCFHP-alum还没开展临床试验,无法确认在人体中的安全性和有效性;
2.相关数据也来自于动物试验,人体免疫反应是否能达到同样水平尚未可知;
3.在疫苗研究和生产过程中的不确定因素较多,在疫苗获批之前无法预估中间会发生什么。
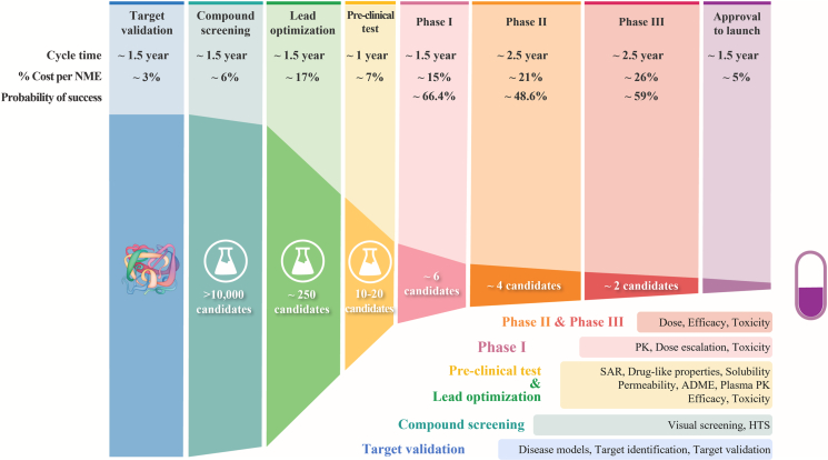
药物发现至开发的过程,以及每一步临床研究的失败率|参考文献[21]
最后也是最关键的一点,就是我们还得看一下新冠病毒的“脸色”,比如问问新冠病毒能不能别再出现逃逸突变了。
但新冠病毒可能会这么回答:我不同意!
此前针对新冠病毒变异趋势的研究[2]发现,体液免疫的压力筛选(可以理解为新冠病毒的物竞天择适者生存),促进了新冠病毒S蛋白上的RBD进化,因此无论是自然感染还是单独针对BA.5的变异株疫苗,都不是解决新冠疫情的方法。
广谱疫苗和广谱单克隆抗体才是未来的优先研发重点。
真正通杀新冠病毒的广谱疫苗,诱导出的中和抗体,应该能更广泛覆盖具有逃逸突变的病毒变异株。
真正有效的广谱单抗,应该不仅能高效应对各类变异株,而且能避免病毒逃逸,避免对病毒的压力筛选。
随着DCFHP-alum的横空出世,广谱、高中和活性的体液免疫反应或许可以被认为已经解决了一定的问题,但另一项预印本研究[23]着实为体液免疫泼了一大盆接近于冰点的冷水。
研究者分析了接种3剂mRNA疫苗后依然被Omicron BA.1、BA.2或BA.4/BA.5突破感染的受试者,在分析了506个S蛋白的NTD和RBD表位后发现:相对原始毒株而言,针对变异株的中和B细胞表位缺失,Omicron BA.2.75.2和XBB变异株中,只有不到12%的野生型毒株表位是保守的。
也就是说,新冠病毒变异后,很容易逃过体液免疫。
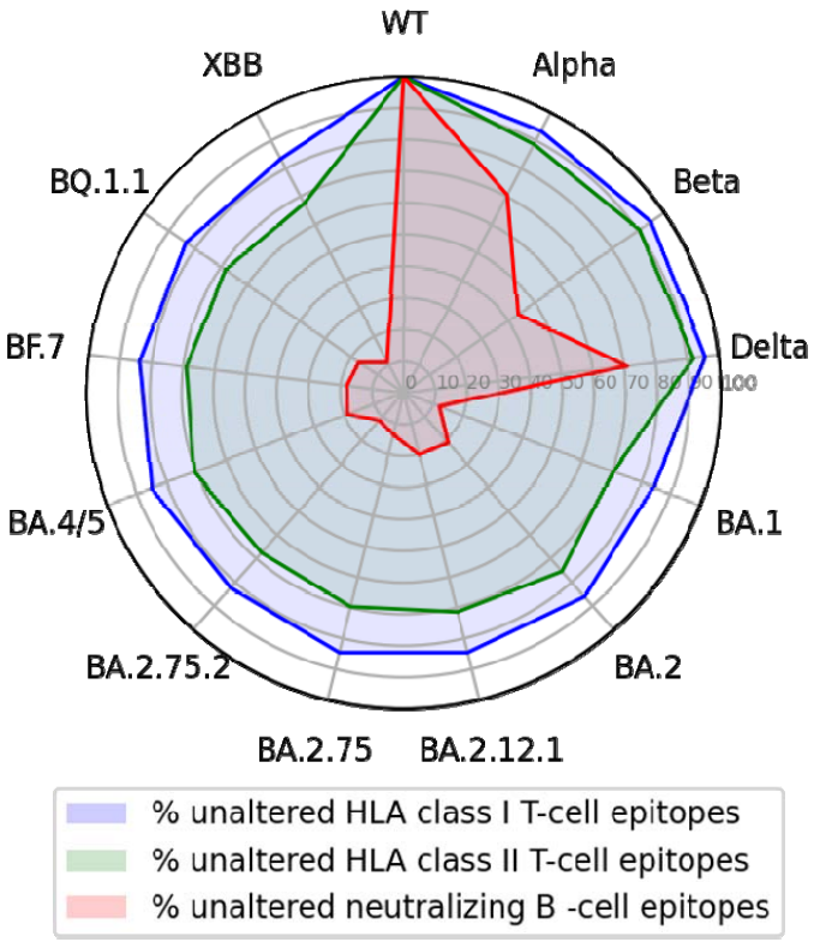
针对S蛋白的T细胞表位基本上是保守的
而这也解释了接种疫苗后诱导的抗体为何对新冠病毒变异株——尤其是Omicron变异株的抗体中和活性越来越差。
不过好在,T细胞免疫仍然能够提供一些支撑,这也解释了为何接种疫苗后即便抗体降低也能提供对重症和死亡的有效保护。
而这只是截至Omicron XBB变异株的结果,未来新冠病毒会产生什么样的逃逸突变仍无法预测,因此广谱疫苗或许能在一定程度上解决这个问题,但并不能彻底扭转乾坤。
除了疫苗之外,既往研究的多种单克隆抗体已经被奥密克戎变异株广泛逃逸[23][24],因此针对新冠病毒S蛋白保守表位的广谱单抗才会成为未来的研发重点之一。
好在通过高通量测序技术已经能够在一定程度上预测未来新冠病毒的逃逸突变趋势,从此让新冠病毒单克隆抗体药物摆脱了“追着病毒跑”的尴尬境地,并且国内外已有多个机构也在研发广谱中和抗体进行单克隆抗体的制备[24]-[28]。
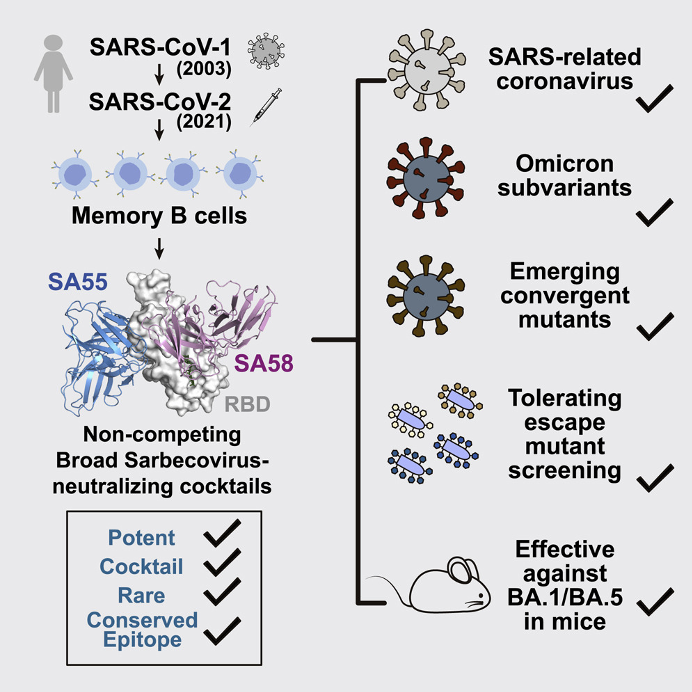
广谱单抗的获取与研究
因此如果想彻底终结新冠疫情,要么新冠病毒保持不变留给我们足够研究有效疫苗和单抗等药物的时间,要么就是新冠病毒自己突变至毁灭,但目前来看,两者似乎都不太可能。
总之,单靠一种新冠疫苗“终结新冠疫情”,仍然不太可能。
扎克伯克点赞的铁蛋白疫苗,是一款值得期待的新疫苗,但还需要更多的临床研究。“比mRNA疫苗强100倍”的数据来自动物试验,到人体内是否还能大幅提升抗体量,还不可知。
无论如何,技术发展带来更好的疫苗和更好的药物,能够让更多人的生命和健康从中获益,这也同样值得期待。
参考文献
[1] Kudlay, Dmitry, and Andrey Svistunov. “COVID-19 Vaccines: An Overview of Different Platforms.” Bioengineering (Basel, Switzerland) vol. 9,2 72. 12 Feb. 2022, doi:10.3390/bioengineering9020072
[2] Diaz-Arévalo, Diana, and Mingtao Zeng. “Nanoparticle-based vaccines: opportunities and limitations.” Nanopharmaceuticals (2020): 135–150. doi:10.1016/B978-0-12-817778-5.00007-5
[3] Cohen, Alexander A et al. “Mosaic RBD nanoparticles protect against challenge by diverse sarbecoviruses in animal models.” Science (New York, N.Y.) vol. 377,6606 (2022): eabq0839. doi:10.1126/science.abq0839
[4] Zhang, Xiantao et al. “Improvement of a SARS-CoV-2 vaccine by enhancing the conjugation efficiency of the immunogen to self-assembled nanoparticles.” Cellular & molecular immunology vol. 18,8 (2021): 2042-2044. doi:10.1038/s41423-021-00736-2
[5] Tai, Wanbo et al. “Development of a ferritin-based nanoparticle vaccine against the SARS-CoV-2 Omicron variant.” Signal transduction and targeted therapy vol. 7,1 173. 1 Jun. 2022, doi:10.1038/s41392-022-01041-8
[6] Weidenbacher, Payton A-B., et al. "A ferritin-based COVID-19 nanoparticle vaccine that elicits robust, durable, broad-spectrum neutralizing antisera in non-human primates." bioRxiv (2022).
[7] Naaber, P., et al. "Dynamics of antibody response to BNT162b2 vaccine after six months: a longitudinal prospective study. Lancet Reg Health Eur 2021; 10: 100208.[Epub ahead of print]." (2021).
[8] Ferdinands, Jill M et al. “Waning 2-Dose and 3-Dose Effectiveness of mRNA Vaccines Against COVID-19-Associated Emergency Department and Urgent Care Encounters and Hospitalizations Among Adults During Periods of Delta and Omicron Variant Predominance - VISION Network, 10 States, August 2021-January 2022.” MMWR. Morbidity and mortality weekly report vol. 71,7 255-263. 18 Feb. 2022, doi:10.15585/mmwr.mm7107e2
[9] Collier, Ai-Ris Y et al. “Differential Kinetics of Immune Responses Elicited by Covid-19 Vaccines.” The New England journal of medicine vol. 385,21 (2021): 2010-2012. doi:10.1056/NEJMc2115596
[10] Pajon, Rolando et al. “SARS-CoV-2 Omicron Variant Neutralization after mRNA-1273 Booster Vaccination.” The New England journal of medicine vol. 386,11 (2022): 1088-1091. doi:10.1056/NEJMc2119912
[11] Falsey, Ann R et al. “SARS-CoV-2 Neutralization with BNT162b2 Vaccine Dose 3.” The New England journal of medicine vol. 385,17 (2021): 1627-1629. doi:10.1056/NEJMc2113468
[12] Puranik, Arjun, et al. "Durability analysis of the highly effective BNT162b2 vaccine against COVID-19." PNAS nexus 1.3 (2022): pgac082.
[13] Qu, Panke, et al. "Durability of booster mRNA vaccine against SARS-CoV-2 BA. 2.12. 1, BA. 4, and BA. 5 subvariants." New England Journal of Medicine 387.14 (2022): 1329-1331.
[14] Amanna, Ian J., Nichole E. Carlson, and Mark K. Slifka. "Duration of humoral immunity to common viral and vaccine antigens." New England Journal of Medicine 357.19 (2007): 1903-1915.
[15] Terpos, Evangelos et al. “SARS-CoV-2 antibody kinetics eight months from COVID-19 onset: Persistence of spike antibodies but loss of neutralizing antibodies in 24% of convalescent plasma donors.” European journal of internal medicine vol. 89 (2021): 87-96. doi:10.1016/j.ejim.2021.05.010
[16] Lim, Joey Ming Er, et al. "A comparative characterization of SARS-CoV-2-specific T cells induced by mRNA or inactive virus COVID-19 vaccines." Cell Reports Medicine 3.11 (2022): 100793.
[17] Mok, Chris Ka Pun et al. “Comparison of the immunogenicity of BNT162b2 and CoronaVac COVID-19 vaccines in Hong Kong.” Respirology (Carlton, Vic.) vol. 27,4 (2022): 301-310. doi:10.1111/resp.14191
[18] Tan, Celine Y et al. “Comparative effectiveness of 3 or 4 doses of mRNA and inactivated whole-virus vaccines against COVID-19 infection, hospitalization and severe outcomes among elderly in Singapore.” The Lancet regional health. Western Pacific vol. 29 100654. 2 Dec. 2022, doi:10.1016/j.lanwpc.2022.100654
[19] Powell, Abigail E et al. “A Single Immunization with Spike-Functionalized Ferritin Vaccines Elicits Neutralizing Antibody Responses against SARS-CoV-2 in Mice.” ACS central science vol. 7,1 (2021): 183-199. doi:10.1021/acscentsci.0c01405
[20] Chan Zuckerberg Biohub Funds First Crop of 47 Investigators. https://www.science.org/content/article/chan-zuckerberg-biohub-funds-first-crop-47-investigators.
[21] Sun, Duxin et al. “Why 90% of clinical drug development fails and how to improve it?.” Acta pharmaceutica Sinica. B vol. 12,7 (2022): 3049-3062. doi:10.1016/j.apsb.2022.02.002
[22] Cao, Yunlong, et al. "Imprinted SARS-CoV-2 humoral immunity induces converging Omicron RBD evolution." bioRxiv (2022).
[23] Muik, Alexander, et al. "Progressive loss of conserved spike protein neutralizing antibody sites in Omicron sublineages is balanced by preserved T-cell recognition epitopes." bioRxiv (2022).
[24] Cao, Yunlong et al. “Rational identification of potent and broad sarbecovirus-neutralizing antibody cocktails from SARS convalescents.” Cell reports vol. 41,12 (2022): 111845. doi:10.1016/j.celrep.2022.111845
[25] Li, Xiaoman et al. “Structural basis of a two-antibody cocktail exhibiting highly potent and broadly neutralizing activities against SARS-CoV-2 variants including diverse Omicron sublineages.” Cell discovery vol. 8,1 87. 8 Sep. 2022, doi:10.1038/s41421-022-00449-4
[26] Li, Tingting, et al. "Potent SARS-CoV-2 neutralizing antibodies with protective efficacy against newly emerged mutational variants." Nature communications 12.1 (2021): 1-11.
[27] Seo, Ji-Min, et al. "Preclinical assessment and randomized Phase I study of CT-P63, a broadly neutralizing antibody targeting severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2)." Emerging Microbes & Infections 11.1 (2022): 2315-2325.
[28] Luo, Sai et al. “An antibody from single human VH-rearranging mouse neutralizes all SARS-CoV-2 variants through BA.5 by inhibiting membrane fusion.” Science immunology vol. 7,76 (2022): eadd5446. doi:10.1126/sciimmunol.add5446
本文来自微信公众号:果壳 (ID:Guokr42),作者:卤煮疫苗
