

扫码打开虎嗅APP
出品 | 虎嗅医疗组
作者 | 陈广晶
题图|视图中国
“肠脑轴”又添力证。
4月15日,Science刊登了法国巴斯德研究所等机构研究者的最新发现:下丘脑神经元可以直接感知肠道细菌微生物群的结构成分,并调节进食和筑巢行为,影响食量和体温。
在这个过程中,细菌肽聚糖通过Nod2受体(核苷酸寡聚化结构域2)起到了主要作用。
研究者敲掉了抑制性γ-氨基丁酸( GABA) 能神经元的Nod2,小鼠,特别是老年雌性小鼠,不再受到肽聚糖衍生物胞壁肽的抑制,摄食行为和温度调节行为发生了改变,包括:比正常小鼠吃得更多,体重也增加更多,更容易发展成为糖尿病,寿命明显缩短。
这也证实了大脑和肠道菌群可以直接对话,且其作用机制可能与肥胖、糖尿病等代谢紊乱问题相关。
上海交通大学生命科学技术学院微生物学特聘教授赵立平告诉虎嗅,这次研究的主要发现——神经元细胞能够对细菌的胞壁肽做出反应,意味着细菌在肠道里种群数量的涨落就对神经元的活动有了直接的调节作用。摄食可通过调节细菌的数量影响食欲中枢的活动。
这给减肥药、糖尿病等代谢紊乱疾病用药研发提供了新路径。
肠道有“第二大脑”之称,近年来有关“肠脑轴”的研究越来越深入。人们已经发现肠道微生物群可以通过在血液中释放化合物方式,调节宿主生理过程,这中间既包括了免疫、新陈代谢,也包括大脑功能。
然而,脑神经元能否直接感知细菌成分,细菌是否可以直接通过调节神经元来调节宿主的生理过程,一直没有得到证实。
本次法国研究者的发现,也被认为是这一领域的首次突破。“胞壁肽能直接作用于下丘脑”,该论文的通讯作者巴斯德研究所的Pierre-Marie Lledo博士也认为,这是“令人惊奇的发现”。
而关于肠道菌群与大脑间相互作用理论体系的搭建,也正在改变人们解读疾病和治疗疾病的思路。
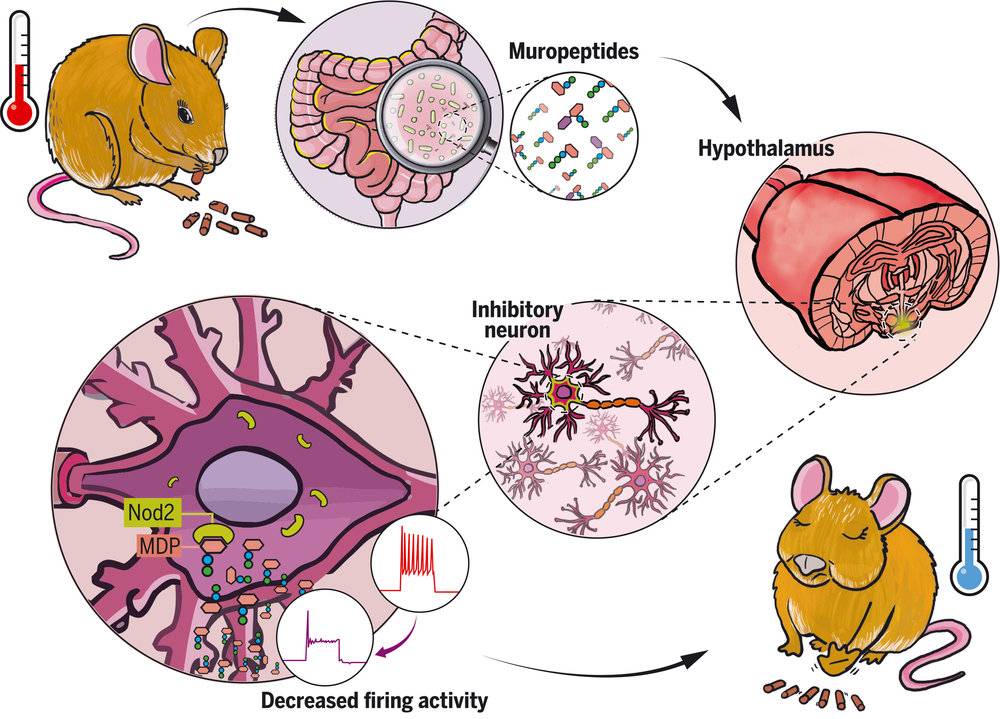
小鼠实验中,肠脑轴控制代谢示意图
来自:Science
肠道菌群塑造大脑
细菌、古细菌、真菌和病毒……
研究表明,哺乳动物的肠道内有1000多个菌群,人体80%以上的细菌都在肠道中。这些微生物的代谢产物和细胞壁碎片,都是大脑感知肠道菌群的关键因素。
按照science发表的《肠道如何与大脑对话》一文所说,这些肠道微生物群不仅无法消灭,反而已经成为大脑发育和行为调节的关键一环。
细菌细胞分裂和死亡过程中,细胞壁降解会产生一种副产物,也就是细菌肽聚糖。这种肽聚糖衍生的胞壁肽,可以抵达大脑并改变有Nod2的大脑神经元一个子集的活动。在老年雌鼠中,这种改变表现为,降低神经元活动,起到增强饱腹感、调节体温的作用。
法国巴斯德研究所的研究者应用脑成像技术观察到,这种影响作用于小鼠大脑的各区域,特别是下丘脑神经元的Nod2受体,在与肠道细菌的胞壁肽接触时,电活动就受到了抑制。
研究者认为,神经元通过直接感知肠道细菌的胞壁肽,来感知肠道菌群的繁衍、死亡等状况,进而判断是否需要进食,其目的都是为了保持肠道菌群的平衡。一旦某种食物摄入过量,就可能会导致肠道菌群的紊乱,进而导致各种健康问题。
肠道与大脑直接交流不畅带来的健康问题,还不止肥胖和血糖问题。此前已有研究认为,肠道菌群与大脑的相互作用,可能还与压力和焦虑、抑郁症、自闭症、阿尔兹海默病病、帕金森等问题相关。
德国研究者2015年发表的研究成果显示,无菌环境中长大的实验鼠大脑出现萎缩、不成熟的小胶质细胞(可修复受损脑组织),对脑内炎症几乎没有反应;同样的,服用抗生素杀灭肠道细菌后,普通实验鼠也出现了脑部免疫应答抑制的现象。
而前述法国学者的最新研究则进一步显示出,肠道菌群与大脑对话过程中,针对不同性别群体产生了不同效果,比如前述提到的细菌肽聚糖,抑制下丘脑摄入食物和控制体温的作用,主要在雌性小鼠中显现。
研究者认为,这或许是女性减肥,以及解决其他代谢紊乱问题开辟了新的思路。而肽聚糖则是精神健康障碍问题治疗的潜在靶点。
肠道菌群也可能逆转衰老,“返老还童”。
此前,爱尔兰科克大学的研究者发现,衰老会导致肠道菌群的巨大变化,这与老年人的健康状态下滑、虚弱等问题相关。由此触发的代谢和免疫反应变化,也会导致大脑功能和行为的紊乱,甚至出现认知损害。
研究者将年轻小鼠的粪便一直到老年小鼠体内,发现老年小鼠的体内菌群发生了20项变化,同时,其衰老相关表现也在减弱。
今年年初Nature刊登的一项结果更是明确,肠道微生物可以控制大脑的焦虑样反应。
研究者将工程菌移植到无菌小鼠体内,使一部分小鼠的粪便、血清、尿液中可以检测到肠道微生物代谢物4-乙基苯基硫酸盐(4EPS),而另一部分小鼠则不能。
电子显微镜断层扫描结果显示,暴露在4EPS中的小鼠脑内髓鞘减少,且髓鞘厚度降低。也就是说,4EPS影响了这些小鼠大脑中髓鞘的形成。而髓鞘作为一种防止神经电冲动的膜,如果发育不良会导致中枢神经功能受损。
将这样的小鼠置于高架十字迷宫、旷场、明暗箱和弹珠掩埋等实验项目中,其焦虑样行为明显增加。在实验中,加入促进少突胶质细胞成熟药物,可以克服4EPS带来的负面影响。
在针对4EPS进行治疗的口服药物1b/2a期临床试验中,研究者也发现,受试的青少年自闭症患者服药后,血液和尿液中的4EPS水平降低,易怒和焦虑情绪也都得到了改善。
越来越多的证据表明,肠道菌群和大脑有频繁的双向互动,很多疾病有望通过调整肠道菌群来予以改善。反之,也要警惕大脑产生的焦虑、压力等情绪,反作用于肠道菌群,带来更多健康问题。
创举还是骗局?
“肠脑轴”理论起源由来已久,最初人们对肠道菌群和人脑之间的联系只停留在猜测层面。早期的动物模型试验表明,压力会扰乱肠道菌群,进而改变宿主行为。
直到2011年以后,才陆续有小鼠实验证明二者之间的关系,肠脑轴理论逐渐形成。基于这一理论,越来越多研究证明,抗生素滥用、加工食品等破坏肠道菌群稳定,都是导致西方发达国家肥胖、血糖问题、阿尔兹海默病、癌症等高发的因素。
这一理论也给很多疾病研究打开了新大门。很过中国学者也在试图用肠脑轴的理论来解释中医药起效的机制。
以色列魏茨曼科学研究所的计算生物学家通过一系列实验发现,人工甜味剂会出现肠道内某些细菌“过于丰富”,其他类型细菌减少的现象。1993年法国开展的一项涉及6.6万名妇女的研究中,饮用人工甜味剂饮料的女性患糖尿病风险,比饮用含糖饮料的人高出了一倍以上。
而在生活上,研究者发现,肠道菌群可以通过免疫调节通道、神经分泌通道、迷走神经等来影响大脑情绪,甚至是睡眠功能,比如通过产生多巴胺、血清素(可启动人的愉悦感)、褪黑素来改善情绪或睡眠问题。
这也令很多人寄希望于通过调整饮食结构、调整肠道菌群,进而改变人体的健康状况。
为此,美国医学博士、职业神经科医生、美国营养学会成员戴维·珀尔马特(David Perlmutter)还写了《菌群大脑》一书,郑重提出了“大脑塑造者康复计划”,推荐多种饮食方案,要帮助读者“吃出健康大脑”。
在中国,由国家卫健委主导下,也推行了健康中国“合理膳食行动”,希望“吃动平衡”,预防疾病。
不过,食品终究是食品,只能改善健康状况,如果真的生病了,食品的“治疗”作用,还是值得商榷的。
而在治疗上,随着研究越来越贴近生活,肠脑轴理论指导的新药研发已经不止停留在理论上。
2021年上海绿谷制药的甘露特钠(GV-971)在中国获国家药监局附条件批准上市,该产品是中国自主研发的创新药,其理论基础就是“肠脑轴”,创下了国际、国内之最。
根据该药的主要发明人、中国科学院上海药物研究所研究员耿美玉,2020年在权威期刊Cell Research上发表的论文,低聚甘露酸钠GV-971 正是通过抑制肠道菌群失调和相关的苯丙氨酸/异亮氨酸积累,来控制神经炎症并逆转认知障碍,从而达到“可靠且持续的认知改善”,治疗阿尔兹海默病的。
在这篇论文中,耿美玉含蓄透露GV-971的3期临床试验结果,称这项在中国开展的为期36周的多中心、随机、双盲、安慰剂对照的临床试验,显示出逆转阿尔兹海默患者认知障碍的效果。
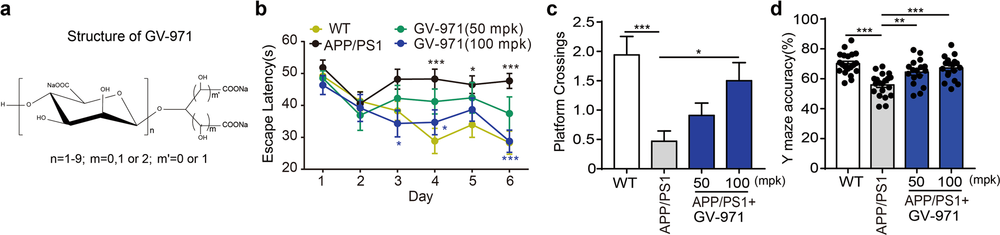
GV-971 对阿尔兹海默病模型小鼠行为变化的影响
来自:Cell Research
根据前期报道,这种药是一种从海藻中提取的海洋寡糖类分子。前期小鼠实验发现,这种物质可以通过调节肠道微生物群来部分改善认知障碍。
然而,附条件批准上市后,该药却遭遇了极大的争议,首都医科大学校长饶毅更是公开质疑甘露特纳“不造假不可能”。
尽管如此,最近一次国家医保目录调整,还是将这款产品纳入其中。作为官方认可,此举虽然又引起了新一轮讨论,但是阶段性认可了该药。
对此,有医药行业人士认为,无论如何,GV-971在多家跨国药企投入巨资无果的情况下,另辟蹊径实现了弯道超车,也算是实现了阿尔兹海默病治疗领域的历史性突破。
另有行业专家向虎嗅指出,这款药要想真正得到认可,还是需要更多更深入的研究。
目前类似阿尔兹海默病、帕金森、抑郁症等神经、精神类疾病,以及一些代谢类疾病、肿瘤治疗、新冠治疗等领域还有很多难题待解。“肠脑轴”作为一个新的视角,打开了新世界的大门。
而具体的治疗方法、药品,都需要得到临床的考验,只有安全性有效性确实“在线”,才能最终站稳脚跟。
参考文献:1、Bacterial sensing via neuronal Nod2 regulates appetite and body temperature,Science
2、Microbiota from young mice counteracts selective age-associated behavioral deficits,Nature
3、Safety and target engagement of an oral small-molecule sequestrant in adolescents with autism spectrum disorder: an open-label phase 1b/2a trial,Nature
4、Sodium oligomannate therapeutically remodels gut microbiota and suppresses gut bacterial amino acids-shaped neuroinflammation to inhibit Alzheimer’s disease progression,Cell Research
5、菌群大脑,戴维·珀尔马特(David Perlmutter) / 克里斯廷·洛伯格(Kristin Loberg)
