

扫码打开虎嗅APP
本文来自微信公众号:Brainology(ID:brain-science),作者:王聪,原文标题:《Neuron:靶向清除胆固醇脂,治疗阿尔茨海默病》,题图来自:视觉中国
阿尔茨海默病(Alzheimer'sdisease,AD),俗称“老年痴呆症”,是一类主要发生于老年人且以进行性认知功能障碍、行为损害为特征的中枢神经系统退行性病变。随着人类平均寿命的增长,阿尔茨海默病的患病率也在不断上升。
载脂蛋白E(APOE)是一种脂质和胆固醇转运蛋白,是阿尔茨海默病的重要遗传风险因素,与APOE3相比,APOE4显著增加阿尔茨海默病风险,而APOE2降低阿尔茨海默病风险。多项研究发现,APOE4与β-淀粉样蛋白(Aβ)沉积增加、tau蛋白过度磷酸化和聚集、认知能力下降加速相关。
2023年11月22日,圣路易斯华盛顿大学和Denali Therapeutics的研究人员在 Cell 子刊 Neuron 上发表了题为:Amelioration of Tau and ApoE4-linked glial lipid accumulation and neurodegeneration with an LXR agonist 的研究论文。
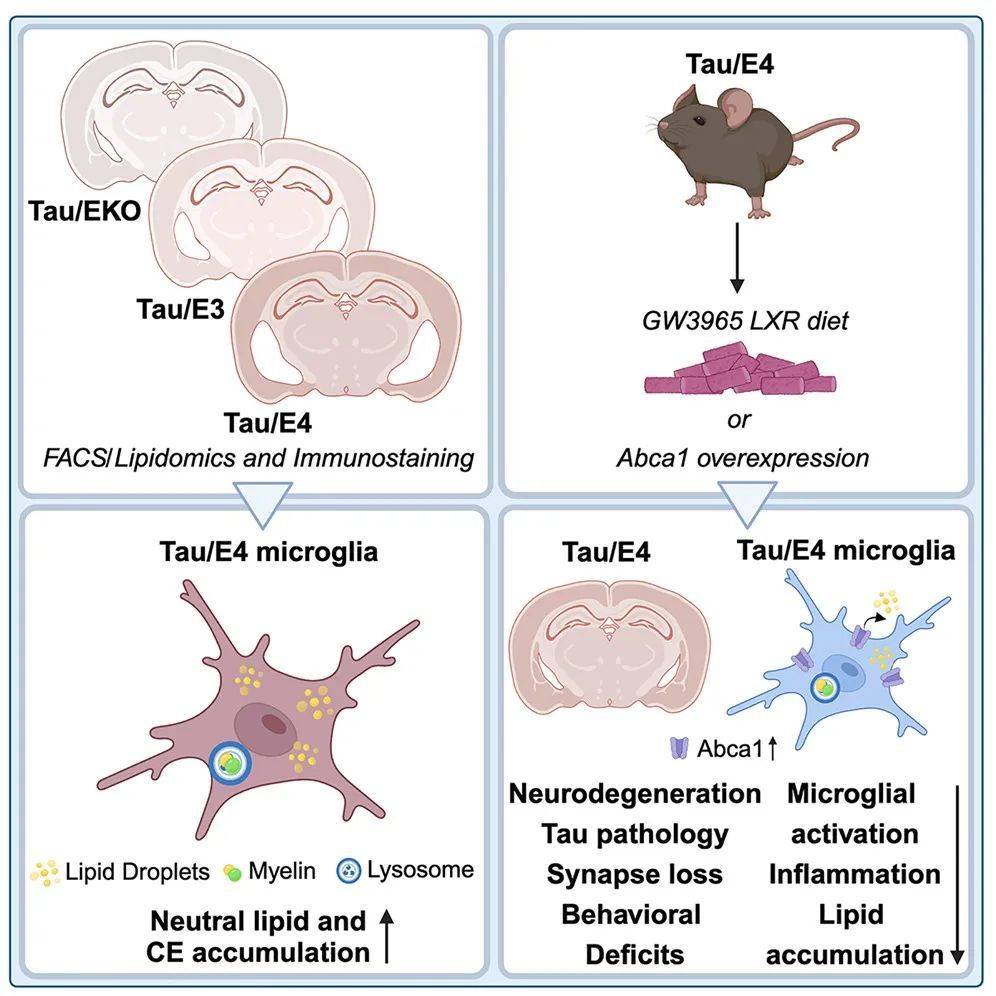
该研究表明,在P301S tau蛋白病小鼠中,ApoE4强烈促进胶质细胞的脂质积累、胆固醇代谢和溶酶体功能紊乱,导致小胶质细胞中的胆固醇酯(cholesteryl ester)异常积累。而使用LXR激动剂或过表达Abca1增加脂质外流,可显著减轻P301S/ApoE4小鼠的tau病理和神经退行性变。
这些研究结果提示我们,减少脑细胞中的胆固醇酯、促进脂质外流,可能是改善tau和ApoE4相关的神经退行性变的有希望的治疗方法。

为了调查APOE、脂质和脑损伤之间的联系,研究团队使用了携带高风险tau基因的P301S tau蛋白病小鼠模型,这种小鼠的大脑易于积累tau蛋白。这些小鼠还携带了第二种基因修饰:它们自己的APOE基因被移除,并被APOE基因的变体取代——APOE3(赋予了阿尔茨海默病的平均风险)、APOE4(使阿尔茨海默病风险增加1~2倍),或者未被取代(作为对照组)。
研究团队观察到APOE4与大脑中扭曲的脂质代谢有关。在9个半月大的携带APOE4的小鼠中,同样的脑部区域萎缩和损伤,也以一种奇怪的方式积累了过多脂质。超过180种脂质的水平发生了改变。其中最显著的区别是,这些区域中被称为小胶质细胞的免疫细胞充满了胆固醇酯(cholesteryl ester),而APOE3没有同样的效果。
进一步研究表明,清除这些脂质可能会减少大脑炎症和神经变性。为了进一步探索这一点,研究团队使用了一种LXR激动剂(GW3965),这是一种降低细胞脂质水平的实验性药物。研究人员从6个月大的时候开始给携带APOE4的tau小鼠喂食GW3965,这些小鼠在9个半月时接受了评估,此时它们的大脑通常已经遭受了相当大的损伤。结果显示,使用该药物治疗的小鼠比使用安慰剂的小鼠保留了更多的脑容量。它们的tau蛋白水平更低,炎症细胞和炎症更少,大脑中突触的损失更少,而且更擅长筑巢。

阿尔茨海默病样小鼠的大脑免疫细胞(红色)中的脂质沉积(绿色)在接受实验药物LXR激动剂治疗后几乎消失了(右图)
进一步分析表明,LXR激动剂通过上调一种名为Abca1的基因起作用,该基因有助于将胆固醇和其他脂质移出细胞。使用遗传学方法增加Abca1基因表达水平具有与使用LXR激动剂治疗相同的效果——减少脂质积累,降低tau蛋白水平,减少炎症,减少神经变性。
研究团队表示,这项研究非常令人兴奋,在动物模型中看到的所有这些影响与人类神经退行性疾病有很多共同特征,这表明该方法可能有很大的在人类中发挥作用的前景。
但在将这种方法应用于人类之前,研究人员还必须克服一大障碍——LXR激动剂会影响肝脏脂质代谢,并可能导致脂肪肝疾病。目前,药物化学家正在努力设计没有这种副作用的LXR激动剂,如果取得成功,由此产生的药物可能对心脏病和脑部疾病都有好处。
研究团队还表示,驱动免疫细胞破坏阿尔茨海默病的大脑的机制与驱动相同类型的免疫细胞导致动脉粥样硬化血管损伤的机制之间有很多相似之处,在这两种情况下,脂质在免疫细胞中积累,使它们变得过度炎症化并损害附近的组织。摆脱脂质积累可能对人类健康有双重好处。
论文链接:https://doi.org/10.1016/j.neuron.2023.10.023
本文来自微信公众号:Brainology(ID:brain-science),作者:王聪
