

扫码打开虎嗅APP
本文来自微信公众号:奇点网(ID:geekheal_com),作者:奇点糕,原文标题:《〈自然〉子刊:年轻血液中的确有不老密码!科学家首次发现,细胞外囊泡的年龄相关变化会导致衰老干细胞中长寿蛋白「失踪」》,题图来自:视觉中国
犹记得几年前,“换血逆转衰老”的新闻着实大火了一阵,甚至还开展了输血抗衰老的临床试验。不过在一些科学家看来,事情大概没这么简单,换血可能是“麻烦又难以奏效”的逆转衰老的方法。搞清楚现象背后的机制,才是解决问题的根本。
在最近的《自然·衰老》杂志上,匹兹堡大学的研究人员发表了他们的最新发现,研究结果显示,在肌肉衰老方面,输注年轻血液带来的衰老逆转是由血液中携带“长寿蛋白”Klotho的细胞外囊泡介导的[1]。这项研究首次表明,细胞外囊泡的年龄相关变化会导致衰老干细胞中Klotho耗尽。

为什么要做这个研究呢?通讯作者Fabrisia Ambrosio博士表示,这个研究结果一定程度上帮助领域内的科学家们了解肌肉随年龄增长衰老的机制,以及肌肉再生该向哪个方向努力,进而,可以考虑继续探索细胞外囊泡作为一种逆转肌肉衰老的治疗方法的潜力[2]。
此前的研究已经发现过,用年轻小鼠来源的血清培养衰老小鼠的肌肉干细胞,可以改善肌肉生成潜能[3,4]。这次,研究人员在实验中复制了这一结果,同时,共培养后,衰老肌肉干细胞子代的MyoD和肌间线蛋白的水平也增加了,这两种分子分别是肌肉生成的主要调节因子和肌肉特异性中间纤维。除此之外,Pax7的水平下降,这是肌谱系扩展的必要变化。

在衰老来源和年轻来源血清中培养的肌间线蛋白阳性肌肉干细胞的比例
年轻的血清还增加了衰老肌肉干细胞的耗氧量,改善了它们的线粒体超微结构,线粒体内膜磷脂——心磷脂的水平增加,它在维持线粒体膜完整性和调节氧化磷酸化方面起着关键作用。
血清中的分子影响线粒体和受体细胞的机制,通常与膜封闭的旁分泌因子或细胞外囊泡(EV)的运输有关[5]。对耗尽EV的年轻和衰老小鼠的血清进行免疫荧光实验和活细胞呼吸实验,研究人员发现,此前的种种变化都消失了,而分离出EV再重新补充进血清中后,“年轻的变化”就回来了。
在衰老小鼠经受骨损伤后,研究人员通过尾静脉给它们注射了年轻小鼠的血清,3天后,EV依赖性的MyoD增加,11天后,骨骼肌的再生和功能恢复显著增强。同样的,没有EV的情况下,注射年轻小鼠的血清也不会有以上效果。
这表明,血液循环中的EV能够被招募到受伤的位置,参与骨骼肌的再生。
为什么年轻的血清EV有这样的“魔力”?研究人员量化了EV的年龄相关变化及其对靶细胞响应的直接影响。他们发现,正常情况下,EV和/或携带的物质会被受体细胞内化,但这个过程会随着年龄的增长而中断。
研究人员分析了313个与EV年龄相关变化有关的表达发生变化的基因,在重要的变化过程中,离子通道调控,尤其是钙离子和钾离子,占据主导地位。

差异化表达基因涉及的通路及评分
与钙离子/钾离子通道活性、线粒体功能和衰老都有关的,研究人员想到了他们曾经发现过的长寿蛋白Klotho,也已经有研究表明,Klotho对于维持肌肉干细胞的线粒体功能和骨骼肌再生能力是必要的[6-8]。
衰老小鼠的肌肉干细胞中Klotho mRNA拷贝相比年轻小鼠更少,导致Klotho蛋白的水平低于年轻小鼠。实验显示,给衰老细胞补充年轻来源的EV后,Klotho蛋白的水平增加。通过基因敲除构建了Klotho缺失(Kl-/-)的小鼠后,补充年轻来源的EV仍然能增加小鼠的Klotho蛋白水平。
研究人员分别从Klotho能够正常产生(Kl+/+)的小鼠和年龄、性别相匹配的Klotho产生受损(Kl+/-)的小鼠中分离出了EV,Kl+/-小鼠的EV中的Klotho mRNA水平显著降低。
给衰老小鼠补充Kl+/-和Kl+/+来源的EV后,与Kl+/+组相比,Kl+/-组大的肌纤维(>600μm2)数量明显较少,纤维化程度高,力量恢复差。同时,线粒体标志物琥珀酸脱氢酶亚基A水平也较低。这表明,EV携带的Klotho mRNA促进了功能性的骨骼肌再生。
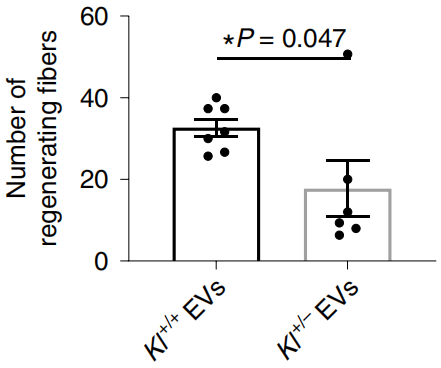
Kl+/+组和Kl+/-组再生肌纤维的数量
总的来说,这项研究表明,EV中的Klotho蛋白随年龄的逐渐耗尽,导致了肌肉的衰老,补充年轻的EV或许会成为肌肉再生,以及肌肉损伤修复的新疗法。
Ambrosio博士透露,下一步,他们的目标在于,开发基于EV的新技术,以及探索是否可以通过非侵入性方法,例如运动,增加衰老肌肉组织中的Klotho蛋白水平,以改善肌肉健康。
参考资料:
[1] https://www.nature.com/articles/s43587-021-00143-2
[2] https://www.eurekalert.org/news-releases/936590
[3] Conboy I M, Conboy M J, Wagers A J, et al. Rejuvenation of aged progenitor cells by exposure to a young systemic environment[J]. Nature, 2005, 433(7027): 760-764.
[4] Brack A S, Conboy M J, Roy S, et al. Increased Wnt signaling during aging alters muscle stem cell fate and increases fibrosis[J]. Science, 2007, 317(5839): 807-810.
[5] Picca A, Guerra F, Calvani R, et al. Mitochondrial dysfunction and aging: Insights from the analysis of extracellular vesicles[J]. International journal of molecular sciences, 2019, 20(4): 805.
[6] Sahu A, Mamiya H, Shinde S N, et al. Age-related declines in α-Klotho drive progenitor cell mitochondrial dysfunction and impaired muscle regeneration[J]. Nature communications, 2018, 9(1): 1-14.
[7] Ahrens H E, Huettemeister J, Schmidt M, et al. Klotho expression is a prerequisite for proper muscle stem cell function and regeneration of skeletal muscle[J]. Skeletal muscle, 2018, 8(1): 1-14.
[8] Wehling-Henricks M, Li Z, Lindsey C, et al. Klotho gene silencing promotes pathology in the mdx mouse model of Duchenne muscular dystrophy[J]. Human molecular genetics, 2016, 25(12): 2465-2482.
本文来自微信公众号:奇点网(ID:geekheal_com),作者:奇点糕
