

扫码打开虎嗅APP
哺乳动物的肠道必须扛得住各种感染原。神经元在过去从不被认为是抵御感染的第一道防线,但最新研究表明,它们可以协助维持肠道的屏障功能,阻止细菌向其他器官扩散。
本文来自微信公众号:Nature自然科研(ID:Nature-Research),原文以 Gut pain sensors help to combat infection为标题发表在2020年4月20日的《自然》新闻与观点版块,原文作者:Romana R. Gerner & Manuela Raffatellu,题图来自:视觉中国
一般认为,对肠道中有害菌的识别及中和是由上皮细胞和免疫细胞共同完成的。但哈佛大学医学院的Lai等人[1]在《细胞》上发表的文章发现,部分肠道神经元在对抗感染中也发挥了意想不到的关键作用。
肠道暴露于各种食物、抗原(被识别为“异己”后可触发免疫反应的分子)、通常无害的共生微生物、有害的微生物(病原体)中。因此,肠道细胞判断敌军和友军的难度可想而知。上皮细胞与免疫细胞相互协作调整这种精细的平衡,既能维护人体对食物抗原和肠道共生菌的免疫耐受,也能启动保护性免疫反应及时清除病原体。肠道神经细胞(包含肠神经系统)可感知源自微生物的分子,并通过与上皮细胞和免疫细胞相互作用促进对微生物的防御反应[2]。
人体肠神经系统约包含108个神经元,这一复杂网络对于许多肠道功能的调控至关重要,如血流量、肠内容物运动等[3]。此外,部分神经细胞还能与肠道免疫系统的组成发生密切作用,甚至还能对其进行调节[4]。
在这些神经元中,有一类被称为疼痛感受器的神经元。当感受到可能有害的刺激,如极冷极热、反应性化学物质、机械性损伤时,这类感受器会引起疼痛或不适感[5]。它们还能直接探测到病原体及其产生的相关分子,并在感染过程中引发疼痛感[6]。但疼痛感受器是否直接帮助抵御细菌侵入宿主组织一直未能明确。
沙门氏菌是引发食物中毒的常见病原菌。沙门氏菌可以引起许多疾病,轻则感染性腹泻(肠胃炎),重则从肠道扩散到其他部位,引起威胁生命的并发症[7,8]。沙门氏菌进入肠道后主要入侵的部位之一就是名为派尔集合淋巴结(Peyer’s patches)的圆顶状滤泡(图1)。
作为肠道调动免疫防御的关键传感器,这些淋巴滤泡通过免疫细胞和被称为M细胞的特殊上皮细胞监测肠道病原体和共生菌并作出响应。M细胞从肠腔中摄取抗原并将其传递给下层的免疫细胞[9],免疫细胞再根据抗原类型决定启动保护性免疫反应还是保持抗原耐受。
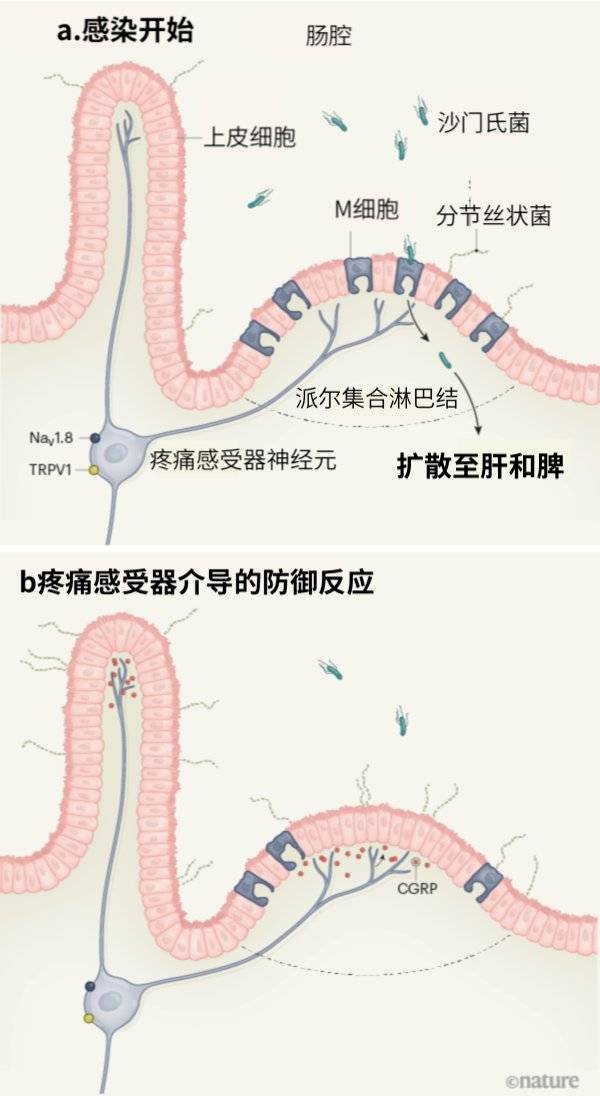
图1 | 哺乳动物肠道神经元帮助抵御细菌感染。Lai等人[1]报告称,被称为疼痛感受器的一类肠道神经元表达TRPV1和NaV1.8蛋白,可抵御沙门氏菌感染小鼠。a,沙门氏菌离开肠腔进入M细胞(“派尔集合淋巴结”区域的特殊上皮细胞),侵入肠道组织,之后还会扩散到其他器官。分节丝状菌(SFB)属于肠道共生菌,可与M细胞或其他肠道上皮细胞结合,具有控制沙门氏菌感染的能力[13]。b,作者报告称,这些疼痛感受器能协调针对沙门氏菌感染的防御反应,主要表现包括M细胞数量减少和肠道SFB定植增加。这些改变与沙门氏菌感染及肠道外扩散减少具有相关性。Lai等人还指出,疼痛感受器主要依靠分泌神经肽CGRP调节M细胞的数量以及SFB水平。
尽管派尔集合淋巴结对于肠内容物的监测起到了重要作用,但某些病原体,如沙门氏菌、诺如病毒(肠胃炎的常见元凶)和朊病毒(感染性的致病蛋白质),会利用M细胞侵入肠道组织[10,11] 。值得注意的是,尽管派尔集合淋巴结与肠道神经元(包括疼痛感受器)在物理位置上相邻,但其功能学联系过去我们并不清楚。
Lai 等人使用小鼠模型评估了疼痛感受器在抵御鼠伤寒沙门菌感染中的作用。研究报告,部分肠道疼痛感受器(特别是能表达离子通道蛋白TRPV1和NaV1.8的疼痛感受器)可保护肠道免受沙门氏菌的侵袭,进而阻止沙门氏菌向肝、脾等器官的传播。
有趣的是,作者发现疼痛感受器的保护作用并非由众所周知的抗菌防御机制介导,如激活免疫细胞或改变肠道细胞产生的抗菌肽水平。实际上,沙门氏菌感染期间,疼痛感受器会调减M细胞的数量。由于M细胞是沙门氏菌的主要入口,一旦其数量减少,沙门氏菌侵袭的面积也可能随之缩小。
研究人员利用基因工程技术使小鼠的肠道疼痛感受器无法表达TRPV1或NaV1.8通道蛋白,并对没有沙门氏菌感染的小鼠肠道菌群组成进行了分析。与正常小鼠相比,缺乏TRPV1或NaV1.8通道蛋白的两种小鼠肠道内的分节丝状菌(SFB)水平均显著下降。分节丝状菌是一类附着于肠道上皮细胞特别是M细胞的肠道共生菌[12],对于抵御病原体(包括沙门氏菌)的肠道定植至关重要[13]。
Lai及其同事研究了M细胞数量减少与派尔集合淋巴结SFB定植程度之间是否存在联系。结果表明,无论是由疼痛感受器介导还是基于抗体实验方法的刺激,M细胞数量减少均可导致SFB定植增加,说明M细胞的数量可调节肠道SFB定植(但确切机制尚未完全明确)。
这种改变是有益的,因为它限制了沙门氏菌的感染,其原因可能是SFB定植增加和M细胞数量减少共同导致了沙门氏菌可利用的侵袭位点减少。最后,Lai等人的研究还提出,当表达TRPV1的疼痛感受器受到沙门氏菌刺激时,会释放一种称为CGRP的神经肽。这个小分子是细胞间的通信分子。CGRP能直接调节M细胞的数量和功能,还能调节肠道中的SFB水平。
该研究首次揭示了肠道疼痛感受器在宿主抵抗沙门氏菌感染中的作用。这一重要发现揭示了哺乳动物肠道上皮细胞、神经元和肠道微生物之间复杂的相互作用,加深了我们对肠道免疫的理解。疼痛感受器介导的免疫反应是否也能抵御其他病原微生物仍有待明确。但确有报道称疼痛感受器在小鼠柠檬酸杆菌感染中具有保护作用[14]。
未来的重点研究方向之一是明确Lai和同事的发现与人类健康是否相关。譬如探索长期使用阿片类止痛药物(如吗啡等)是否会影响疼痛感受器介导的抗菌作用。这一问题值得研究是因为疼痛感受器恰好是阿片类药物的主要靶点,而向小鼠喂食吗啡会改变其肠道微生物组成[15,16]。
此外,使用吗啡会促进某些类型的微生物(革兰氏阴性菌)从肠道扩散到人体其他部位,这一过程可能导致败血症,甚至威胁生命[15,16]。进一步探索感染过程中肠道神经元与免疫细胞之间相互作用或能带来令人振奋的新发现,刷新我们对于宿主防御的理解。
参考文献:
1. Lai, N. Y. et al. Cell 180, 33–49 (2020).
2. Yoo, B. B. & Mazmanian, S. K. Immunity 46, 910–926 (2017).
3. Kulkarni, S. et al. J. Neurosci. 38, 9346–9354 (2018).
4. Schneider, S., Wright, C. M. & Heuckeroth, R. O. Annu. Rev. Physiol. 81, 235–259 (2019).
5. Julius, D. & Basbaum, A. I. Nature 413, 203–210 (2001).
6. Baral, P., Udit, S. & Chiu, I. M. Nature Rev. Immunol. 19, 433–447 (2019).
7. Majowicz, S. E. et al. Clin. Infect. Dis. 50, 882–889 (2010).
8. Gordon, M. A. J. Infect. 56, 413–422 (2008).
9. Mabbott, N. A., Donaldson, D. S., Ohno, H., Williams, I. R. & Mahajan, A. Mucosal Immunol. 6, 666–677 (2013).
10. Jung, C., Hugot, J.-P. & Barreau, F. Int. J. Inflam. 2010, 823710 (2010).
11. Chiocchetti, R. et al. Cell Tissue Res. 332, 185–194 (2008).
12. Meyerholz, D. K., Stabel, T. J. & Cheville, N. F. Infect. Immun. 70, 3277–3280 (2002).
13. Garland, C. D., Lee, A. & Dickson, M. R. Microb. Ecol. 8, 181–190 (1982).
14. Ramirez, V. T. et al. J. Infect. Dis.
https://doi.org/10.1093/infdis/jiaa014 (2020).
15. Wang, F. et al. Sci. Rep. 8, 3596 (2018).
16. Hilburger, M. E. et al. J. Infect. Dis. 176, 183–188 (1997).
本文来自微信公众号:Nature自然科研(ID:Nature-Research),原文作者:Romana R. Gerner & Manuela Raffatellu
